题目内容
【题目】氯碱工业中制碱的原料是饱和食盐水,由于粗盐中含有泥沙和Ca2+、Mg2+、Fe3+、SO42-等杂质,不符合电解要求,因此必须经过精制。学校实验小组精制粗盐水的实验过程如下:
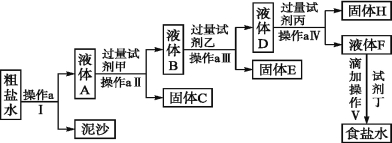
请回答以下问题:
(1)操作a的名称是 ,所用玻璃仪器是 。
(2)在第Ⅱ步中,加入过量试剂甲后,生成了两种大量的沉淀,则试剂甲为 溶液(写化学式)。
(3) 试剂丙为 溶液(写化学式)。判断试剂丙是否过量的方法是: ____________。
(4)在第Ⅴ步中,加入试剂丁直到溶液无明显变化时,写出此过程的化学方程式 ___________________。
【答案】
(1)过滤;玻璃棒、漏斗、烧杯(2)NaOH
(3)Na2CO3 ;向上层清液中滴加盐酸,若产生气泡,则Na2CO3过量。(其它正确答案均可得分)
(4)NaOH+HCl=NaCl+H2O,Na2CO3+2HCl=2NaCl+H2O+CO2↑
【解析】
试题分析:(1)在食盐水中,实现溶液和泥沙难溶物的分离可以采用过滤的方法,过滤用到的仪器有玻璃棒、漏斗、烧杯,故答案为:过滤;玻璃棒、漏斗、烧杯;
(2)粗盐中含有Ca2+、Mg2+、Fe3+、SO42-杂质,加入过量试剂氢氧化钠后,可以将镁离子以及铁离子形成氢氧化镁和氢氧化铁沉淀,故答案为:NaOH;
(3)溶液D中含有OH-、Ca2+、Ba2+,加入过量碳酸钠溶液,除去Ca2+、Ba2+;检验碳酸钠是否过量可以向上层清液中滴加盐酸,若产生气泡,则Na2CO3过量,故答案为:Na2CO3 ;向上层清液中滴加盐酸,若产生气泡,则Na2CO3过量;
(4)在第Ⅴ步中,加入试剂盐酸可以讲过量的氢氧化钠以及过量的碳酸钠除掉,此过程的化学方程式为:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+CO2↑+H2O,故答案为:NaOH+HCl=NaCl+H2O;Na2CO3+2HCl=2NaCl+CO2↑+H2O。

 名校课堂系列答案
名校课堂系列答案