题目内容
阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
A、用酸式滴定管取稀H2SO425.00mL,注入锥形瓶中,加入指示剂。
B、用待测定的溶液润洗酸式滴定管
C、用蒸馏水洗干净滴定管
D、取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至刻度“0”或“0”刻度以下
E、检查滴定管是否漏水
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写) ;
②该滴定操作中应选用的指示剂是 ;
③在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”或“恰好合适”)
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用_____ _的NaOH溶液,原因是______________ ________。
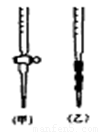
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 __(选填“甲”或“乙”)中。
(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度(计算结果到小数点后二位) 。
(1)①ECDBAGF;②酚酞;③无色变为浅红色(或粉红色)且半分钟不褪去。
(2)偏大 (3)100.00mL容量瓶(1分)
(4)0.1mol/L;溶液浓度越稀,误差就越小
(5)乙(1分) (6)偏小 (7)4.20mol/L
【解析】(1)考查中和滴定的实验操作
①正确的顺序为ECDBAGF
②强碱滴定强酸,终点时溶液显中性,所以选择酚酞作指示剂。
③当溶液中出现无色变为浅红色(或粉红色)且半分钟不褪去时,反应即达到滴定终点。
(2)碱式滴定管未用标准液润洗,相当于稀释了氢氧化钠,消耗氢氧化钠溶液的体积增加,所以测定结果偏高。
(3)准确配制一定物质的量浓度的溶液所需要的主要仪器是100.00mL容量瓶。
(4)溶液浓度越小,反应越慢,消耗的溶液体积越大,误差越小。
(5)乙是碱式滴定管,氢氧化钠应该注入乙中。
(6)滴定前仰视,则读数偏大。滴定后俯视,则读数偏小,所以消耗的氢氧化钠溶液体积偏小,测定结果偏低。
(7)硫酸是二元酸,所以硫酸的浓度是0.015L×0.14mol/L÷0.025L×2=0.042mol/L。因此最初硫酸的浓度是0.042mol/L×100=4.20mol/L.

 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案(10分)阅读下列实验内容,根据题目要求回答问题。
某学生为测定未知浓度的硫酸溶液,实验如下:用1.00mL待测硫酸配制100mL稀H2SO4溶液;以0.14mol·L-1的NaOH溶液滴定上述稀H2SO4 25.00mL,滴定终止时消耗NaOH溶液15.00mL。
(1)该学生用标准0.14mol·L-1 NaOH溶液滴定硫酸的实验操作如下:
| A.用酸式滴定管取稀H2SO4 25.00mL,注入锥形瓶中,加入2滴酚酞。 |
| B.用待测定的溶液润洗酸式滴定管 |
| C.用蒸馏水洗干净滴定管 |
| D.取下碱式滴定管用标准的NaOH溶液润洗后,将标准液注入碱式滴定管刻度“0”以上2—3cm处,再把碱式滴定管固定好,调节液面至 刻度“0”或“0”刻度以下 |
F、另取锥形瓶,再重复操作一次
G、把锥形瓶放在滴定管下面,瓶下垫一张白纸,边滴边摇动锥形瓶直至滴定终点,记下滴定管液面所在刻度
①滴定操作的正确顺序是(用序号填写)E→ C → D→ → → →F ;
②在G操作中如何确定终点? 。
(2)碱式滴定管用蒸馏水润洗后,未用标准液润洗导致滴定结果(填“偏小”、“偏大”
或“恰好合适”) 。
(3)配制准确浓度的稀H2SO4溶液,必须使用的主要容器是: 。
(4)如有1mol/L和0.1mol/L的NaOH溶液,应用 的NaOH溶液。
(5)用标准NaOH溶液滴定时,应将标准NaOH溶液注入 (选填“甲”或“乙”)中。(右图)

(6)观察碱式滴定管读数时,若滴定前仰视,滴定后俯视,则结果会导致测得的稀H2SO4溶液浓度测定值 (选填“偏大”“偏小”或“无影响”)
(7)计算待测硫酸(稀释前的硫酸)溶液的物质的量浓度 (计算结果到小数点后二位)。


