题目内容
【题目】用NA表示阿伏加德罗常数,下列说法中正确的有:
A. 2.4g金属镁与足量盐酸反应,转移电子的数目为0.1NA ;
B. 1L1mol/L的CaCl2溶液中含Cl-的数目为NA;
C. 在25℃、1.01×105Pa的条件下,2.24L H2中含有的分子数小于0.1NA;
D. 22 g CO2与标准状况下11.2 L H2O含有相同分子数
【答案】C
【解析】
A. 2.4 g金属镁与足量盐酸反应,转移电子的数目为0.2NA,故A错误;B. CaCl2![]() Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。
Ca2++2Cl-,1L 1 mol·L-1的CaCl2溶液中含Cl-的数目为2NA,故B错误;C. 在25℃、1.01×105Pa的条件下,气体摩尔体积大于22.4L/mol,所以2.24 L H2的物质的量小于0.1mol,含有的分子数小于0.1 NA,故C正确;D. 22 g CO2的物质的量是0.5mol,标准状况下水呈非气态,11.2 L H2O的物质的量大于0.5mol,所以22 g CO2与标准状况下11.2 L H2O含有的分子数不同,故D错误。故选C。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
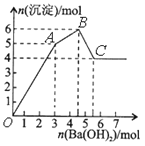
学业测评一课一测系列答案【题目】向FeCl3、Al2(SO4)3的混和溶液中逐滴加入Ba(OH)2(aq),形成沉淀的情况如下图所示。沉淀的生成的pH列于下表(已知:偏铝酸钡易溶于水)。以下推断正确的是
氢氧化物 | 溶液pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.3 | 3.4 |
Al(OH)3 | 3.3 | 5.2 |
A. OA段产生的沉淀为BaSO4和Fe(OH)3
B. 据图计算原溶液中c(Cl-)=c(SO42-)
C. AB段可能发生的反应是:2SO42-+ 2Ba2++ Al3++3OH-=2BaSO4↓+Al(OH)3↓
D. C点溶液呈碱性是因为AlO2-水解,离子方程式为:AlO2-+2H2O=Al(OH)3+OH-
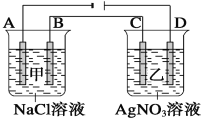
【题目】下述实验方案能达到实验目的的是( )
编号 | A | B | C | D |
实验方案 |
|
|
|
|
实验目的 | 实验室制备乙酸乙酯 | 分离乙酸和水 | 验证溴乙烷在氢氧化钠乙醇溶液中发生消去反应产生的乙烯 | 收集乙烯并验证它与溴水发生加成反应 |
A. A B. B C. C D. D