题目内容
【题目】下列叙述正确的是
A. 15g甲基(-CH3)中含有的电子数为9NA
B. 标准状况下,2.24L己烷中所含碳原子数为0.6NA
C. 0.1mol Fe与足量稀硫酸反应时,转移电子数为0.3NA
D. 由2SO2+O2![]() 2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
2SO3可知,2mol SO2与1mol O2充分反应生成SO3分子数为2NA
【答案】A
【解析】
A、甲基的式量是15,15g甲基的物质的量为1mol.一个甲基中含有9个电子,所以1mol甲基含有电子9mol电子,即9NA,选项A正确;
B、标准状况下正己烷(C6H14)不是气体,2.24 L不是0.1 mol,所含碳原子数不为0.6NA,选项B错误;
C、0.1molFe与足量稀硫酸反应生成硫酸亚铁和氢气,转移电子数目为0.2NA,选项C错误;
D.二氧化硫与氧气反应为可逆反应,可逆反应不能进行到底,所以2mol SO2和1mol O2充分反应,生成SO3的分子数小于2 NA,选项D错误;
答案选A。

 阅读快车系列答案
阅读快车系列答案【题目】某实验小组用0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液进行中和热的测定。
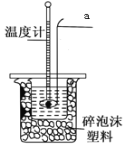
(1)测定稀硫酸和稀氢氧化钠中和热的实验装置如图所示,其中仪器a的名称为_____________;
(2)写出该反应中和热的热化学方程式(中和热为57.3 kJ·mol-1)______________;
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
① 请填写下表中的空白:
温度 实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | __________ |
2 | 27.0 | 27.4 | 26.2 | 31.2 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
② 近似认为0.50 mol·L-1 NaOH溶液和0.50 mol·L-1 硫酸溶液的密度都是1 g·cm-3,中和后生成溶液的比热容c=4.18kJ·(kg·℃)-1。则中和热ΔH=________________________(取小数点后一位);
③ 上述实验数据结果与57.3 kJ·mol-1有偏差, 产生偏差的原因不可能是(填字母)________。
a.实验装置保温、隔热效果差
b.量取NaOH溶液的体积时仰视读数
c.分多次把NaOH溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度