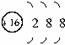题目内容
下列表达方式正确的是( )
分析:A.同一轨道内的2个电子自旋方向应该相反;
B.钠原子的内层电子排布为1s22s22p6,应是Ne的排布式;
C.最外层电子数不能超过8,根据核外电子排布规律书写;
D.水分子中氢原子与氧原子之间形成1对共用电子对,氧原子有2对孤对电子对.
B.钠原子的内层电子排布为1s22s22p6,应是Ne的排布式;
C.最外层电子数不能超过8,根据核外电子排布规律书写;
D.水分子中氢原子与氧原子之间形成1对共用电子对,氧原子有2对孤对电子对.
解答:解:A.同一轨道内的2个电子自旋方向应该相反,钠原子失去3s的1个电子形成钠离子,钠离子核外有10个电子,Na+的电子排布图: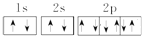 ,故A错误;
,故A错误;
B.钠原子的核外电子排布式为1s22s22p63s1,内层电子排布为1s22s22p6,Na原子的简化电子排布式:[Ne]3s1,故B错误;
C.钾原子核外电子数为19,有4个电子层,各层电子数为2、8、8、1,原子结构示意图为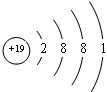 ,故C错误;
,故C错误;
D.水分子中氢原子与氧原子之间形成1对共用电子对,氧原子有2对孤对电子对,电子式为 ,故D正确;
,故D正确;
故选D.
 ,故A错误;
,故A错误;B.钠原子的核外电子排布式为1s22s22p63s1,内层电子排布为1s22s22p6,Na原子的简化电子排布式:[Ne]3s1,故B错误;
C.钾原子核外电子数为19,有4个电子层,各层电子数为2、8、8、1,原子结构示意图为
 ,故C错误;
,故C错误;D.水分子中氢原子与氧原子之间形成1对共用电子对,氧原子有2对孤对电子对,电子式为
 ,故D正确;
,故D正确;故选D.
点评:本题考查常用化学用语的书写,难度中等,注意理解掌握核外电子排布规律.

练习册系列答案
相关题目