题目内容
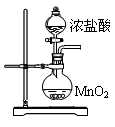
三氯化磷(PCl3)是一种重要的有机合成催化剂。实验室常用红磷与干燥的Cl2制取PCl3,装置如下图所示。

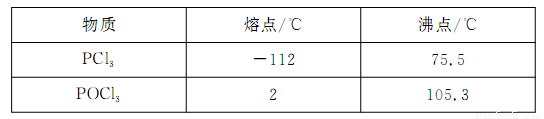
已知:红磷与少量Cl2反应生成PCl3,与过量Cl2反应生成PCl5。PCl3遇O2会生成POCl3(三氯氧磷), POCl3溶于PCl3,PCl3遇水会强烈水解生成H3PO3和HCl。PCl3、POCl3的熔沸点见下表。
|
物质 |
熔点/℃ |
沸点/℃ |
|
PCl3 |
-112 |
75.5 |
|
POCl3 |
2 |
105.3 |
请答下面问题:
(1)B中所装试剂是 ,F中碱石灰的作用是 。
(2)实验时,检查装置气密性后,向D装置的曲颈甑中加入红磷,打开K3通入干燥的CO2,一段时间后,关闭K3,加热曲颈甑至上部有黄色升华物出现时通入氯气,反应立即进行。通干燥CO2的作用是 ,
(3)实验制得的粗产品中常含有POCl3、PCl5等。加入红磷加热除去PCl5后,通过 (填实验操作名称),即可得到较纯净的PCl3。
(4)C装置中的K1、K2的设计也出于类似的目的,为了达到这一实验目的,实验时与K1、K2有关的操作是 。
(5)实验后期关闭K1,打开K2,将气体通入C装置中发生反应,反应后的溶液为X。某同学设计实验来确定溶液X中含有的某些离子,请补充完成实验步骤和现象。
|
实验步骤 |
实验现象 |
实验结论 |
|
① |
|
溶液X中含有Na+ |
|
② |
|
溶液X中含有Cl- |
(5)玻璃管之间的连接需要用到胶皮管,连接的方法是:先把 ,然后稍稍用力即可把玻璃管插入橡皮管。甲同学将装置A的示意图画成右图,该示意图中明显的错误是 。
(1) 浓硫酸(1分)吸收多余的Cl2,防止空气中的水蒸气进入烧瓶与PCl3反应。(2分)
(2) 排尽装置中的空气,防止红磷自燃。(1分)
先关闭K1,打开K2,等B中溶液上方充满黄绿色气体后,打开K1,关闭K2。(2分)
(3) 蒸馏 (1分)
(4)
|
实验步骤 |
实验现象 |
|
①用铂丝(光洁无锈的铁丝)蘸取溶液X,在酒精灯外焰上灼烧(1分) |
火焰呈黄色(1分) |
|
②取少量溶液X,加入足量稀HNO3(1分),再滴加少量AgNO3溶液(1分) |
出现白色沉淀(1分) |
(5)把玻璃管口用水润湿(1分) 没有(用酒精灯)加热 (1分)
【解析】
试题分析:
(1)B为浓硫酸,碱石灰用于吸收多余的氯气和防止空气中水汽进入装置。
(2)通CO2的目的为了排装置的空气。
(3)蒸馏
(4)参考上表。
(5)玻璃管装橡胶管时必须要润湿,实验室制氯气必须加热。
考点:考查了实验的基本操作和实验设计和分析。

 名校课堂系列答案
名校课堂系列答案| A、在平衡体系PCl5(g)?PCl3(g)+Cl2(g)中加入一定量的37Cl2,一段时间后37Cl存在于五氯化磷、三氯化磷和氯气这三种物质中 | B、CH3COOH与H18O-CH2CH3发生酯化反应是可逆反应,达到平衡后,18O仅存在于乙醇和乙酸乙酯分子里,不可能存在于乙酸和水分子里 | C、在氧气中完全燃烧后生成物只有CO2和H2O的有机物一定是烃 | D、CH2Cl2没有同分异构体的事实证明了甲烷分子是以碳原子为中心的正四面体结构 |
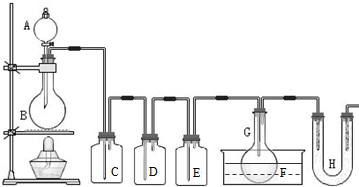 (2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下:
(2011?静安区模拟)用如图所示装置制取PCl3,在E中放入足量白磷,将氯气不间断地通入E,氯气与白磷就会发生反应,并放出热量(温度高于75℃).已知:PCl3和 PCl5遇水强烈反应,它们熔沸点数据如下: