题目内容
【题目】氨气及含氮化合物在化工生产和国防工业中具有广泛应用。请回答:
(1)已知:(i)氢气的燃烧热为286.0 kJ mol-1
(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O △H=-1530.6kJmol-1。
2N2(g)+6H2O △H=-1530.6kJmol-1。
①合成氨反应的热化学方程式为__________________________________。
②对于反应(ii),正、逆反应活化能的大小关系为:E正_______E逆 (填>、=或<)。
(2)恒温恒容条件下,起始按物质的量之比为1 : 1向密闭容器中充入N2(g)和H2(g),发生合成氨的反应。达平衡后,N2(g)的体积分数为_________;然后只降低温度,N2(g)的体积分数会______(填选项字母)。
A.增大 B.减小 C.不变 D.不能判断
(3)T℃ 时,CO2(g)和 NH3(g)合成尿素的原理为 2NH3(g)+ CO2(g)![]() CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
CO(NH2)2(s)+H2O(l)。在2 L恒容密闭容器中,通入1.2 mol NH3(g)和0.6 mol CO2(g),2 min时反应恰好达到平衡,测得c(NH3)=0.2mol L-1
①0-2 min内,用NH3表示的反应速率v(NH3)=___________;反应的平衡常数K=__________。
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,在3 min时重新达到平衡,请在图1中画出23 min内c(NH3)随时间(t)变化的曲线关系图:__________。

(4)电化学降解法可用于治理水中硝酸盐的污染,电化学降解NO3-的原理如图2所示:
①电源正极为___________(填“A”或“B”),阴极反应式为________________________________。
②若电解过程中转移了 1 mol e-,则膜两侧电解液的质量变化差值(Δm正-Δm右)为________g。
【答案】 N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.7 kJ·mol-1 < 50% C 0.2 mol·L-1·min-1 250
2NH3(g) ΔH=-92.7 kJ·mol-1 < 50% C 0.2 mol·L-1·min-1 250 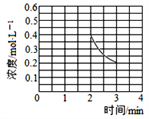 A 2NO+6H2O+10e-===N2↑+12OH- 7.2
A 2NO+6H2O+10e-===N2↑+12OH- 7.2
【解析】(1)①已知:(i)氢气的燃烧热为286.0 kJ mol-1,则H2(g)+ ![]() O2(g)=H2O(g) △H1=-286.0kJmol-1,(ii)4NH3(g)+3O2(g)
O2(g)=H2O(g) △H1=-286.0kJmol-1,(ii)4NH3(g)+3O2(g)![]() 2N2(g)+6H2O △H2=-1530.6kJmol-1,根据盖斯定律,由①×3-②×
2N2(g)+6H2O △H2=-1530.6kJmol-1,根据盖斯定律,由①×3-②×![]() 可得反应N2(g)+3H2(g)
可得反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=△H1×3-△H2×
2NH3(g) ΔH=△H1×3-△H2×![]() =-286.0kJmol-1×3-(-1530.6kJmol-1)×
=-286.0kJmol-1×3-(-1530.6kJmol-1)×![]() =-92.7 kJ·mol-1;②对于反应(ii) 4NH3(g)+3O2(g)
=-92.7 kJ·mol-1;②对于反应(ii) 4NH3(g)+3O2(g)![]() 2N2(g)+6H2O △H=-1530.6kJmol-1,反应为放热反应,反应物的总能量高于生成物的总能量,反应物达到活化分子所需要能量低,故正、逆反应活化能的大小关系为:E正<E逆;(2)开始
2N2(g)+6H2O △H=-1530.6kJmol-1,反应为放热反应,反应物的总能量高于生成物的总能量,反应物达到活化分子所需要能量低,故正、逆反应活化能的大小关系为:E正<E逆;(2)开始![]() (N2)=
(N2)= ![]() ×100%=50%,设开始氮气、氢气的物质的量分别为1mol、1mol,则
×100%=50%,设开始氮气、氢气的物质的量分别为1mol、1mol,则
N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
初始量 1 1 0
转化量 x 3x 2x
平衡量 1-x 1-3x 2x
平衡后氮气的体积分数为![]() ×100%=50%,则氮气的体积分数恒为50%;由此可见,平衡时氮气的体积分数保持不变,答案选C;
×100%=50%,则氮气的体积分数恒为50%;由此可见,平衡时氮气的体积分数保持不变,答案选C;
(3)① 2NH3(g)+ CO2(g)![]() CO(NH2)2(s)+H2O(l)
CO(NH2)2(s)+H2O(l)
初始量(mol/L) 0.6 0.3 0 0
转化量(mol/L) 0.4 0.2 0.1 0.1
平衡量(mol/L) 0.2 0.1 0.1 0.1
v(NH3)= ![]() =0.2 mol·L-1·min-1;K=
=0.2 mol·L-1·min-1;K=![]() =
=![]() =250;
=250;
②若其他条件不变,2 min时将容器体积迅速压缩到1 L,此时c(NH3)=0.4 mol/L,保持T℃不变,则3 min平衡时c(NH3)仍为,故图象为: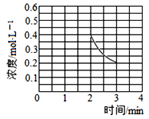 ;(4)由图示知在Ag-Pt电极NO3-上发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知阴极上发生的电极反应式为:2NO+6H2O+10e-===N2↑+12OH-;②转移1mol电子时,阳极产生氧气8g,并产生1gH+进入阴极室,阳极室质量减少9g,阴极室中放出0.1molN2,质量减少2.8g,同时有1molH+进入阴极室,阴极室质量共减少1.8g,若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差值(Δm正-Δm右)为9g-1.8g=7.2g。
;(4)由图示知在Ag-Pt电极NO3-上发生还原反应,因此Ag-Pt电极为阴极,则B为负极,A为电源正极;在阴极反应是NO3-得电子发生还原反应生成N2,利用电荷守恒与原子守恒知阴极上发生的电极反应式为:2NO+6H2O+10e-===N2↑+12OH-;②转移1mol电子时,阳极产生氧气8g,并产生1gH+进入阴极室,阳极室质量减少9g,阴极室中放出0.1molN2,质量减少2.8g,同时有1molH+进入阴极室,阴极室质量共减少1.8g,若电解过程中转移了1mol电子,则膜两侧电解液的质量变化差值(Δm正-Δm右)为9g-1.8g=7.2g。

 阅读快车系列答案
阅读快车系列答案