题目内容
 已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:
已知A、B、C、D两种短周期元素,分别属于不同的主族,其原子序数依次增大,其中A与D、B与C的原子的最外层电子数之和均为9,A原子的最外层与次外层电子数相等,A、B、C、D中只有两种金属元素.试回答下列问题:(1)A的元素符号为
Be
Be
,C的氢化物的化学式为H2S
H2S
.(2)为比较C与D的单质的氧化性强弱,可设计实验以证实,则该实验所依据的反应的化学方程式为
Fe+S
FeS,2Fe+3Cl2
2FeCl3(或H2S+Cl2═S↓+2HCl)
| ||
| ||
Fe+S
FeS,2Fe+3Cl2
2FeCl3(或H2S+Cl2═S↓+2HCl)
.
| ||
| ||
(3)1molC的氢化物与足量C的氧化物反应,转移的电子的物质的量为
2
2
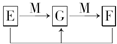
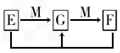
mol.(4)已知E、G、F是均含有B元素的化合物,其有关转化关系如图,请写出E与F反应生成G的离子方程式
Al3++3AlO2-+6H2O═4Al(OH)3
Al3++3AlO2-+6H2O═4Al(OH)3
.分析:A原子的最外层与次外层电子数相等可知A为Be.A与D最外层电子数之和为9,可知D最外层7个电子,且分别属于不同的主族,D为Cl.和为9,且A、B、C、D中只有两种金属元素,可知B最外层3个电子,B为Al.C为S.
解答:解:(1)A原子的最外层与次外层电子数相等可知A为Be.A与D最外层电子数之和为9,可知D最外层7个电子,且分别属于不同的主族,D为Cl.和为9,且A、B、C、D中只有两种金属元素,可知B最外层3个电子,B为Al.C为S.C的氢化物的化学式为H2S.
(2)氧化性:Cl2>S,根据氧化性:氧化剂>氧化产物,则有H2S+Cl2═S↓+2HCl.
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱.如:Fe+S
FeS,2Fe+3Cl2
2FeCl3
(3)SO2+2H2S=3S↓+2H2O,1mol二氧化硫得到4mol电子,1mol硫化氢失2mol电子.
(4)B为Al,常见存在形式为AlO2-,Al(OH)3,Al3+,
故答案为:(1)Be H2S
(2)Fe+S
FeS,2Fe+3Cl2
2FeCl3(或H2S+Cl2═S↓+2HCl)
(3)2
(4)Al3++3AlO2-+6H2O═4Al(OH)3
(2)氧化性:Cl2>S,根据氧化性:氧化剂>氧化产物,则有H2S+Cl2═S↓+2HCl.
当含有变价元素的还原剂在相似的条件下作用于不同的氧化剂时,可根据氧化产物价态的高低来判断氧化剂氧化性强弱.如:Fe+S
| ||
| ||
(3)SO2+2H2S=3S↓+2H2O,1mol二氧化硫得到4mol电子,1mol硫化氢失2mol电子.
(4)B为Al,常见存在形式为AlO2-,Al(OH)3,Al3+,
故答案为:(1)Be H2S
(2)Fe+S
| ||
| ||
(3)2
(4)Al3++3AlO2-+6H2O═4Al(OH)3
点评:本题考查原子结构,氧化还原反应及铝及其化合物的性质.

练习册系列答案
 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案
相关题目
 2FeCl3(或H2S+Cl2═S↓+2HCl)
2FeCl3(或H2S+Cl2═S↓+2HCl)
 2FeCl3(或H2S+Cl2═S↓+2HCl)
2FeCl3(或H2S+Cl2═S↓+2HCl)