题目内容
【题目】已知:常温下,![]()
![]() ,
,![]() ,某二元酸
,某二元酸![]() 及其钠盐的溶液中,
及其钠盐的溶液中,![]() 、
、![]() 、
、![]() 分别在三者所占的物质的量分数
分别在三者所占的物质的量分数![]() 随溶液pH变化关系如图所示,下列叙述错误的是
随溶液pH变化关系如图所示,下列叙述错误的是

A.在![]() 的溶液中:
的溶液中:![]()
B.等体积等浓度的NaOH溶液与![]() 溶液混合后,溶液中水的电离程度比纯水小
溶液混合后,溶液中水的电离程度比纯水小
C.在![]() 的溶液中存在
的溶液中存在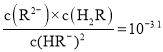
D.向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]()
【答案】D
【解析】
据图可知,在二元酸H2A及其钠盐的溶液中,随着pH的增大,H2A的物质的量分数逐渐减小,HA-的物质的量分数先增大后减小,A2-的物质的量分数逐渐增大。pH=1.3时, c(H2A)=c(HA-),![]()
![]() =c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),
=c(H+)=10-1.3;pH=4.4时,c(HA-)=c(A2-),![]() =c(H+)=10-4.4;Ka1
=c(H+)=10-4.4;Ka1![]() Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
Ka2>10-14,所以HA-电离>水解,NaHR溶液显酸性。根据以上认识,结合其它电解质溶液知识可解答各小题。
![]() 在
在![]() 的溶液中,
的溶液中,![]() ,溶液中电荷守恒为:
,溶液中电荷守恒为:![]() ,所以
,所以![]() ,故A正确;
,故A正确;
B. 等体积等浓度的NaOH溶液与![]() 溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
溶液混合后,生成NaHR,溶液显酸性,HA-电离>水解,水的电离受到抑制,所以溶液中水的电离程度比纯水小,故B正确;
C. 当溶液![]() 时,
时,![]() ,则
,则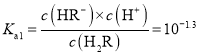 ,溶液的
,溶液的![]() 时,
时,![]() ,则
,则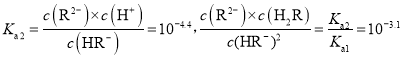 ,故C正确;
,故C正确;
D. 由C选项分析可知,![]() 的电离常数
的电离常数![]() 大于
大于![]() 的
的![]() ,即酸性:
,即酸性:![]() ,所以向
,所以向![]() 溶液中加入少量
溶液中加入少量![]() 溶液,发生反应:
溶液,发生反应:![]() ,故D错误;
,故D错误;
答案选D

练习册系列答案
 ABC考王全优卷系列答案
ABC考王全优卷系列答案
相关题目