题目内容
【题目】我国西部大部分山区的许多村庄,仍以饮用未经任何处理的地表水为主,这些地表水受到不同程度的污染,对山区群众的身体健康造成不利影响。目前国务院和各级政府投入大量资金,采取积极措施为这些村庄建水厂、安装自来水管道,让群众喝上清洁、卫生的水。
(1)硬水可用 来区分。硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦。生活中可用 来降低水的硬度。
(2)硬水在加热或久置时,会产生水垢[主要成分是Mg(OH)2和CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式: 、 。
(3)自来水生产过程中,可用 方法除去水中不溶性杂质,同时还必须进行消毒杀菌。ClO2是一种新型的自来水消毒剂,其中氯元素与氧元素的质量比为 ,氯的原子结构示意图为 。
(4)水通电分解的化学方程式 。
【答案】(1)肥皂水;加热煮沸
(2) Mg(OH)2+2HCl=MgCl2+2H2O、CaCO3+2HCl=CaCl2+H2O+CO2↑
(3)过滤 ; 71:64 ; 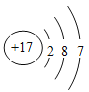
(4)2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
【解析】
试题分析:(1)钙离子、镁离子能与肥皂水反应产生白色沉淀,因此硬水可用肥皂水来区分。硬水中含有较多可溶性钙、镁化合物,它们在加热的条件下可以分解,因此生活中可用加热煮沸来降低水的硬度。
(2)盐酸和氢氧化镁、碳酸钙反应的化学方程式分别是Mg(OH)2+2HCl=MgCl2+2H2O、CaCO3+2HCl=CaCl2+H2O+CO2↑。
(3)自来水生产过程中,可用过滤的方法除去水中不溶性杂质,同时还必须进行消毒杀菌。根据化学式ClO2 可知氯元素与氧元素的质量比为=35.5:32=71:64;氯的核电荷数是17,则其原子结构示意图为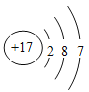 。
。
(4)电解水生成氢气和氧气,反应的方程式为2H2O![]() 2H2↑+O2↑。
2H2↑+O2↑。

 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案【题目】现有一瓶物质甲和乙的混合物,已知甲和乙的某些性质如表所示:
物质 | 分子式 | 熔点(℃) | 沸点(℃) | 密度 (g·cm-3) | 水中的溶解性 |
甲 | C3H6O2 | -98 | 57.5 | 0.93 | 可溶 |
乙 | C4H8O2 | -84 | 77 | 0.90 | 可溶 |
据此,将甲和乙分离的最佳方法是
A.萃取法 B.升华法 C.蒸馏法 D.分液法
