题目内容
 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是C
C
.(填字母)A.C(s)+H2O(g)=CO(g)+H2(g)△H>0
B.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H<0
C.2CO(g)+O2(g)=2CO2(l)△H<0
(2)以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其负极的电极反应式为
CO-2e-+4OH-=CO32-+2H2O
CO-2e-+4OH-=CO32-+2H2O
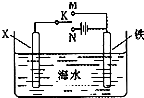
.(3)利用如图装置,可以模拟铁的电化学防护.若X为碳棒,为减缓铁的腐蚀,开关K应该置于
N
N
处,该保护法的名称是外加电流的阴极保护法
外加电流的阴极保护法
,此时溶液中的阴离子向X
X
极(填X或铁)移动.分析:(1)能设计成原电池的反应必须是放热反应,同时必须是氧化还原反应;
(2)燃料电池中,负极上投放燃料,正极上投放氧化剂,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)为减缓铁的腐蚀,如果用铁和比铁活泼的金属作电极,可以将其设计成原电池,如果用铁和碳作电极材料,则
铁棒必须作电解池的阴极,该保护法的名称是外加电流的阴极保护法,溶液中阳离子向阴极移动,阴离子向阳极移动.
(2)燃料电池中,负极上投放燃料,正极上投放氧化剂,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应;
(3)为减缓铁的腐蚀,如果用铁和比铁活泼的金属作电极,可以将其设计成原电池,如果用铁和碳作电极材料,则
铁棒必须作电解池的阴极,该保护法的名称是外加电流的阴极保护法,溶液中阳离子向阴极移动,阴离子向阳极移动.
解答:解:(1)能设计成原电池的反应必须是放热反应,同时必须是氧化还原反应,
A.该反应是吸热反应,故不选;
B.该反应不是氧化还原反应,故不选;
C.该反应是氧化还原反应,且是放热反应,故选;
故选C;
(2)燃料电池中,负极上投放燃料,正极上投放氧化剂,负极上一氧化碳失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CO-2e-+4OH-=CO32-+2H2O;
故答案为:CO-2e-+4OH-=CO32-+2H2O;
(3)电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,溶液中阴离子向阳极即X极移动;
故答案为:N;外加电流的阴极保护法,X.
A.该反应是吸热反应,故不选;
B.该反应不是氧化还原反应,故不选;
C.该反应是氧化还原反应,且是放热反应,故选;
故选C;
(2)燃料电池中,负极上投放燃料,正极上投放氧化剂,负极上一氧化碳失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CO-2e-+4OH-=CO32-+2H2O;
故答案为:CO-2e-+4OH-=CO32-+2H2O;
(3)电极材料是铁和碳棒,铁比碳活泼,所以为减缓铁的腐蚀,必须将其设计成电解池,且铁作阴极,碳棒作阳极,该保护法的名称是外加电流的阴极保护法,溶液中阴离子向阳极即X极移动;
故答案为:N;外加电流的阴极保护法,X.
点评:本题以原电池、电解池原理为载体考查了原电池的设计、金属的腐蚀与防护,注意能设计成原电池的反应必须是放热反应,同时必须是氧化还原反应.

练习册系列答案
相关题目
 短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
短周期元素Q、R、T、W在元素周期表中的位置如右图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:


