题目内容
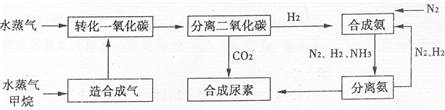
化学一化学与技术我国有丰富的天然气资源.以天然气为原料合成尿素的主要流程如图所示(图中某些转化步骤及生成物未列出)
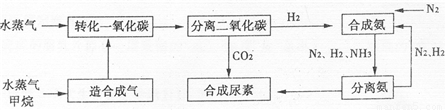
请填写下列空白:
(1)合成尿素的反应分二步,请写出该反应的化学方程式
①______ NH2COONH4
【答案】分析:(1)在高温高压条件下,NH3与CO2反应生成NH2COONH4,NH2COONH4加热分解生成CO(NH2)2与H2O.
(2)A.催化剂不影响平衡移动.
B.由工艺流程可知,进入分离二氧化碳装置的气体有H2O、CH4、H2、CO2等.
C.N2、H2的循环使用,提高了原子的利用率.
D.由游离态的氮元素转化为化合态,称为固氮.
E.天然气是化石能源,属于不可再生资源,.
(3)500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.
降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动.
根据关系式CH4~CO~3H2计算造合成气的反应中生成的CO、H2的体积,根据关系式 CO~H2计算分离二氧化碳过程生成的H2体积,两部分氢气体积为生成氢气的总体积,再根据 3H2~2NH3计算生成氨气的体积.
解答:解:(1)在高温高压条件下,NH3与CO2反应生成NH2COONH4,NH2COONH4加热分解生成CO(NH2)2与H2O.
反应方程式为①2NH3+CO2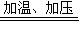 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4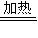 CO(NH2)2+H2O.
CO(NH2)2+H2O.
故答案为:①2NH3+CO2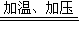 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4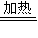 CO(NH2)2+H2O.
CO(NH2)2+H2O.
(2)A.使用催化剂加快反应速率,缩短到达平衡时间,催化剂不影响平衡移动,CO的转化率不变,故A错误;
B.由工艺流程可知,进入分离二氧化碳装置的气体有H2O、CH4、H2、CO2等,故B错误;
C.N2、H2的循环使用,充分利用氮元素、氢元素,提高了原子的利用率,故C正确;
D.氨中的氮元素属于化合态,二氧化碳与氨合成尿素,不是游离态的氮元素转化为化合态,不属于人工固氮,故D错误;
E.天然气是化石能源,属于不可再生资源,故E错误.
故选:C.
(3)合成氨反应是放热反应,虽然温度越高对反应有抑制作用,但是在500度时催化剂的活性最大,反应速率也很快.综合考虑工业生产选择500度的高温.
故答案为:500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.所以反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数k=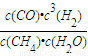 .
.
降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动,故该反应正反应为吸热反应.
根据关系式计算造合成气的反应中生成的CO、H2的体积:
合成气的反应中:CH4~~~~~~~~~CO~~~~~~~~~~3H2,
5.60xlO7L×0.75 5.60xlO7L×0.75 5.60xlO7L×0.75×3
分离二氧化碳过程生成的H2体积:CO~~~~~~~~~~H2,
5.60xlO7L×0.75 5.60xlO7L×0.75
所以产生的氢气的总体积为5.60xlO7L×0.75×3+5.60xlO7L×0.75=5.60xlO7L×0.75×4
令产生氨气的体积为V,则:
3H2~~~~~~~~~2NH3
3 2
5.60xlO7L×0.75×4×40% V
解得,V=5.60xlO7L×0.75×4×40%× =4.48xlO7L
=4.48xlO7L
故答案为: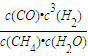 ;吸;4.48xlO7L.
;吸;4.48xlO7L.
点评:考查学生对工艺流程的理解、化学平衡移动及平衡常数与计算、合成氨条件的选择等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.(4)中计算为易错点,容易忽略分离二氧化碳过程生成的H2体积.
(2)A.催化剂不影响平衡移动.
B.由工艺流程可知,进入分离二氧化碳装置的气体有H2O、CH4、H2、CO2等.
C.N2、H2的循环使用,提高了原子的利用率.
D.由游离态的氮元素转化为化合态,称为固氮.
E.天然气是化石能源,属于不可再生资源,.
(3)500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.
降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动.
根据关系式CH4~CO~3H2计算造合成气的反应中生成的CO、H2的体积,根据关系式 CO~H2计算分离二氧化碳过程生成的H2体积,两部分氢气体积为生成氢气的总体积,再根据 3H2~2NH3计算生成氨气的体积.
解答:解:(1)在高温高压条件下,NH3与CO2反应生成NH2COONH4,NH2COONH4加热分解生成CO(NH2)2与H2O.
反应方程式为①2NH3+CO2
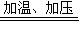 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4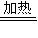 CO(NH2)2+H2O.
CO(NH2)2+H2O.故答案为:①2NH3+CO2
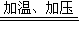 NH2COONH4,②NH2COONH4
NH2COONH4,②NH2COONH4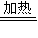 CO(NH2)2+H2O.
CO(NH2)2+H2O.(2)A.使用催化剂加快反应速率,缩短到达平衡时间,催化剂不影响平衡移动,CO的转化率不变,故A错误;
B.由工艺流程可知,进入分离二氧化碳装置的气体有H2O、CH4、H2、CO2等,故B错误;
C.N2、H2的循环使用,充分利用氮元素、氢元素,提高了原子的利用率,故C正确;
D.氨中的氮元素属于化合态,二氧化碳与氨合成尿素,不是游离态的氮元素转化为化合态,不属于人工固氮,故D错误;
E.天然气是化石能源,属于不可再生资源,故E错误.
故选:C.
(3)合成氨反应是放热反应,虽然温度越高对反应有抑制作用,但是在500度时催化剂的活性最大,反应速率也很快.综合考虑工业生产选择500度的高温.
故答案为:500℃的温度反应速率较快,催化剂活性最高.
(4)平衡常数指产物浓度系数次幂的乘积与反应物浓度系数次幂的乘积的比值.所以反应CH4(g)+H2O(g)?CO(g)+3H2(g)的平衡常数k=
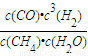 .
.降低温度,平衡常数K减小,平衡向逆反应进行,降低温度平衡向放热反应方向移动,故该反应正反应为吸热反应.
根据关系式计算造合成气的反应中生成的CO、H2的体积:
合成气的反应中:CH4~~~~~~~~~CO~~~~~~~~~~3H2,
5.60xlO7L×0.75 5.60xlO7L×0.75 5.60xlO7L×0.75×3
分离二氧化碳过程生成的H2体积:CO~~~~~~~~~~H2,
5.60xlO7L×0.75 5.60xlO7L×0.75
所以产生的氢气的总体积为5.60xlO7L×0.75×3+5.60xlO7L×0.75=5.60xlO7L×0.75×4
令产生氨气的体积为V,则:
3H2~~~~~~~~~2NH3
3 2
5.60xlO7L×0.75×4×40% V
解得,V=5.60xlO7L×0.75×4×40%×
 =4.48xlO7L
=4.48xlO7L故答案为:
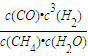 ;吸;4.48xlO7L.
;吸;4.48xlO7L.点评:考查学生对工艺流程的理解、化学平衡移动及平衡常数与计算、合成氨条件的选择等,难度中等,关键是掌握整个制备流程原理,要求学生要有扎实的基础知识和灵活应用知识解决问题的能力.(4)中计算为易错点,容易忽略分离二氧化碳过程生成的H2体积.

练习册系列答案
相关题目