题目内容
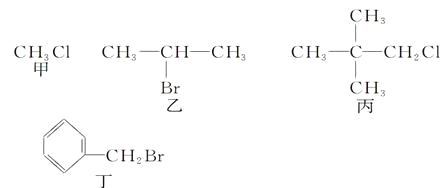
【题目】下列反应的离子方程式书写不正确的是
A. 钠与水反应:2Na+2H2O=2Na+ + 2OH- +H2↑
B. 电解饱和食盐水获取碱和氯气:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
C. 向碳酸氢铵溶液中加入过量石灰水:Ca2+ +HCO3- +OH-=CaCO3 ↓+H2O
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
【答案】C
【解析】A. 钠与水反应:2Na+2H2O=2Na+ + 2OH- +H2↑,质量、电荷均守恒,故A正确;B. 电解饱和食盐水获取碱和氯气:2Cl-+2H2O![]() Cl2↑+H2↑+2OH-,质量、电荷均守恒,故B正确;C. 向碳酸氢铵溶液中加入过量石灰水:NH4++HCO3- +Ca2+ +2OH-=CaCO3 ↓+NH3H2O+H2O,故C错误;D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,质量、电荷均守恒,故D正确;故选C。
Cl2↑+H2↑+2OH-,质量、电荷均守恒,故B正确;C. 向碳酸氢铵溶液中加入过量石灰水:NH4++HCO3- +Ca2+ +2OH-=CaCO3 ↓+NH3H2O+H2O,故C错误;D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,质量、电荷均守恒,故D正确;故选C。

【题目】某校化学探究小组同学为探究乙酸乙酯的制备与水解情况,甲、乙同学分别使用图1、图2装置制备乙酸乙酯。

已知:①无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH。②相关有机物的沸点:
试剂 | 乙醚 | 乙醇 | 乙酸 | 乙酸乙酯 |
沸点(℃) | 34.7 | 78.5 | 117.9 | 77 |
(1)甲同学在制得乙酸乙酯后,分离乙酸乙酯与饱和碳酸钠溶液的操作是_______________。
(2)试管中装有饱和Na2CO3溶液,其作用是________(填序号)。
A.吸收乙醇 B.除去乙酸
C.乙酸乙酯在饱和Na2CO3溶液中的溶解度更小,有利于分层析出
D.加速酯的生成,提高其产率
(3)甲同学分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,应先加入无水氯化钙,分离出______________;再加入____________(填序号);然后进行蒸馏,收集77 ℃左右的馏分,以得到较纯净的乙酸乙酯。
A.五氧化二磷 B.碱石灰 C.无水硫酸钠 D.生石灰
(4)为证明浓硫酸在该反应中起到了催化剂和吸水剂的作用,乙同学利用图2所示装置进行了以下四个实验,实验开始先用酒精灯微热3 min,再加热使之微微沸腾3 min。实验结束后充分振荡试管B,再测有机层的厚度,实验记录如下:

①实验D的目的是与实验C相对照,证明H+对酯化反应具有催化作用。实验D中应加入盐酸的体积和浓度分别是________mL和________mol·L-1。
②分析实验________(填实验编号)的数据,可以推测出浓硫酸的吸水性提高了乙酸乙酯的产率。
【题目】以软锰矿(主要成分为MnO2)和硫锰矿(主要成分为MnS)为原料(已知两种原料中均不含有单质杂质)制备高纯度硫酸锰的工艺流程如图所示。
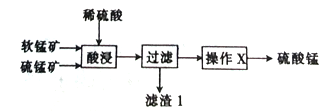
(1)已知滤渣1中含有一种非金属单质,该非金属单质的化学式为_____________________。
(2)已知二氧化锰与硫化锰的物质的量之比对酸浸时的浸出率有影响,相关实验数据如下表所示。当二氧化锰与硫化锰的物质的量之比为______________时,为最优反应配比。
号 | 二氧化锰与硫化锰的物质的量之比 | 浸出液的pH | 浸出率% |
1 | 1.25:1 | 2.5 | 95.30 |
2 | 1.75:1 | 2.5 | 97.11 |
3 | 2.25:1 | 2.5 | 99.00 |
4 | 2.5:1 | 2.5 | 98.40 |
(3)操作X为蒸发浓缩、______________、过滤,洗涤、烘干,在洗涤操作中,常用酒精洗涤MnSO4·H2O晶体,其主要目的是_________。
(4)现有10t锰矿,其中MnO2和MnS的含量均为29%,若流程中Mn的损耗率为10%,则最终制得硫酸锰(MnSO4·H2O)_________t。