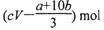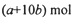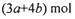题目内容
将a mol FeO 和 b mol Cu2S投入到VL浓度为cmol?L-1的硝酸溶液中恰好完全反应,生成dmol NO气体,得到Fe(NO3)3,Cu(NO3)2,H2SO4的混合液,则反应中未被还原的硝酸不可能为( )
| A、(cV-d)mol | ||
B、(cV-
| ||
| C、(a+10b)mol | ||
| D、(3a+4b)mol |
分析:反应中硝酸起氧化剂、酸作用,未被还原的硝酸将转化为Fe(NO3)3、Cu(NO3)2中,由Fe、Cu元素守恒计算未被还原的硝酸的物质的量;起氧化剂作用的硝酸生成NO,NO的物质的量为dmol,根据电子转移守恒,也可以用a、b表示处于NO的物质的量,根据氮元素守恒可知,未被还原的硝酸物质的量=原硝酸总物质的量-NO的物质的量,据此解答解答.
解答:解:反应中硝酸起氧化剂、酸作用,起酸的作用的硝酸未被还原,
未被还原的硝酸将转化为Fe(NO3)3、Cu(NO3)2中,根据元素守恒可知,n[Fe(NO3)3]=n(Fe)=amol,n[Cu(NO3)2]=n(Cu)=2bmol,所以未被还原的硝酸的物质的量=3amol+4bmol=(3a+4b)mol;
起氧化剂作用的硝酸生成NO,NO的物质的量为dmol,根据氮元素守恒,则未被还原的硝酸的物质的量=VL×cmol/L-dmol=(cV-d)mol;
根据电子转移守恒可知,NO的物质的量=
=
mol,根据氮元素守恒,则未被还原的硝酸的物质的量=VL×cmol/L-
mol=(cV-
)mol,
综上所述,ABD正确,C错误,故选C.
未被还原的硝酸将转化为Fe(NO3)3、Cu(NO3)2中,根据元素守恒可知,n[Fe(NO3)3]=n(Fe)=amol,n[Cu(NO3)2]=n(Cu)=2bmol,所以未被还原的硝酸的物质的量=3amol+4bmol=(3a+4b)mol;
起氧化剂作用的硝酸生成NO,NO的物质的量为dmol,根据氮元素守恒,则未被还原的硝酸的物质的量=VL×cmol/L-dmol=(cV-d)mol;
根据电子转移守恒可知,NO的物质的量=
| amol+bmol×10 |
| 3 |
| a+10b |
| 3 |
| a+10b |
| 3 |
| a+10b |
| 3 |
综上所述,ABD正确,C错误,故选C.
点评:本题以元素化合物知识为载体,考查氧化还原反应中守恒法计算技巧,侧重对学生思维能力的考查,难度中等.

练习册系列答案
相关题目
(12分)下列三个反应在某密闭容器中进行:
反应① Fe(s)+CO2(g) FeO(s)+CO(g) △H1=" a" kJ·mol-1
FeO(s)+CO(g) △H1=" a" kJ·mol-1
反应② 2CO(g)+O2(g) 2CO2(g) △H2=" b" kJ·mol-1
2CO2(g) △H2=" b" kJ·mol-1
反应③ 2Fe(s)+O2(g) 2FeO(s) △H3
2FeO(s) △H3
(1)则△H3= (用含a、b的代数式表示)
(2)已知500℃时反应①的平衡常数K=1.0,在此温度下2L密闭容器中进行反应①,Fe和CO2的起始量均为2.0mol,达到平衡时CO2的转化率为
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是CO2浓度的两倍,则
a 0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其它条件不变时,可以采取的措施有 (填序号)。
| A.缩小反应器体积 | B.再通入CO2 |
| C.升高温度 | D.使用合适的催化剂 |
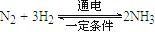 。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。
。则在电解法合成氨的过程中,应将H2不断地通入 极(填“正”、“负”、 “阴” 或“阳”);在另一电极通入N2,该电极反应式为 。(5)在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应后溶液中c(NH4+)=c(Cl-),则溶液显___________性(填“酸”“碱”或“中”), 可推断a 0.01(填大于、等于或小于)。
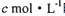 的硝酸溶液中恰好完全反应,生成dmol NO气体,得到
的硝酸溶液中恰好完全反应,生成dmol NO气体,得到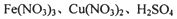 的混合液,则反应中未被还原的硝酸不可能为
的混合液,则反应中未被还原的硝酸不可能为