题目内容
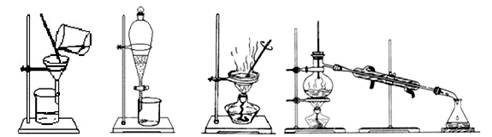
如图各装置不能达到实验目的的是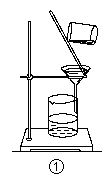

| A.装置①可用于从Fe(OH)3胶体中过滤出Fe(OH)3胶粒 |
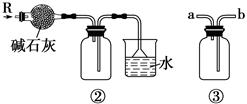
| B.装置②可用于干燥、收集氨气,并吸收多余的氨气 |
| C.装置③可用于排空气法收集NO2气体 |
| D.装置④可用于证明Cl2易与NaOH溶液反应 |
A
解析试题分析:A.胶体的粒子能透过滤纸,因此不能从Fe(OH)3胶体中过滤出Fe(OH)3胶粒。错误。B. 氨气是碱性气体,可以用碱性干燥剂碱石灰干燥。由于氨气的密度比空气小,所以用向上排空气法收集。氨气是大气污染物,要进行尾气处理。由于氨气极容易溶解于水,为了使氨气被充分吸收又防止倒吸现象的发生,常在导气管的末端按一个倒扣的漏斗。正确。C. NO2容易与水发生反应:3NO2+ H2O == 2HNO3+ NO。所以它只能用排空气法收集。由于NO2的密度比空气大,所以用向上排空气法收集。正确。D.如果Cl2易与NaOH溶液反应,就会使烧瓶中的气体压强减小,这时烧杯中的NaOH溶液就会在大气压强的作用下被压入烧瓶,气体继续反应,导致烧瓶内外又产生压强差,这样NaOH溶液不断进入到烧瓶而形成喷泉。如果Cl2与NaOH溶液不容易发生反应,就不会形成喷泉实验。正确。
考点:考查胶粒的大小、气体的干燥、收集、完全处理及喷泉实验的形成等知识。

练习册系列答案
相关题目
某澄清溶液可能含有K+、Al3+、Mg2+、NH4+、Fe2+、SO42-、CO32-中的一种或几种,为确定其成分,进行如下实验:①取部分溶液,逐滴滴入用HCl酸化的BaCl2溶液,只产生白色沉淀;②另取部分溶液,缓慢加入足量的Na2O2固体并加热,产生无色无味的气体,同时产生白色沉淀后白色沉淀部分溶解。下列推断正确的是
| A.肯定有Al3+、SO42-,可能有K+、NH4+ |
| B.肯定无NH4+、Mg2+、CO32-,可能有Fe2+ |
| C.原溶液一定是明矾和MgSO4的混合溶液 |
| D.肯定有Mg2+,K+只能通过焰色反应才能确定 |
对于某纯净物溶液中离子的检验及结论正确的是
| A.加入稀盐酸产生无色气体,将气体通入澄清石灰水,溶液变浑浊,一定有CO32- |
| B.加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| C.加入足量稀盐酸无现象,再加入氯化钡溶液,有白色沉淀产生,一定有SO42- |
| D.加入碳酸钠溶液产生白色沉淀,再加盐酸沉淀消失,一定有Ba2+ |
从海水中提取镁的工业生产流程如下: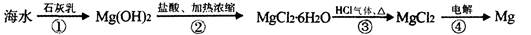
下列说法错误的是
| A.此法的优点之一是原料来源丰富 |
| B.该提取镁的过程中涉及置换、分解、复分解和氧化还原反应 |
| C.步骤①②③的目的是从海水中提取无水MgCl2 |
| D.步骤②中加盐酸的离子方程式为Mg(OH)2+2H+=Mg2++2H2O |
下列实验操作与预期目的或所得结论一致的是
| A.用铂丝蘸取某溶液进行焰色反应,火焰呈黄色,证明该溶液中一定不含有K+ |
| B.向浓度均为0.1 mol·L-1NaCl和NaI混合溶液中滴加少量AgNO3溶液,产生黄色沉淀,说明Ksp(AgCl)>Ksp(AgI) |
| C.向某溶液中加入硝酸酸化的Ba(NO3)2溶液,出现白色沉淀,说明该溶液一定含有SO42- |
| D.在乙酸、乙醇与乙酸乙酯的混合物中加入适量饱和烧碱溶液充分混合后分液,可得到较纯净的乙酸乙酯 |
下列混合物分离(或除杂)的方法正确的是
| | 物质 | 杂质 | 药品 | 操作 |
| A | 溴水 | NaCl | 酒精 | 萃取 |
| B | 乙醇 | 醋酸 | NaOH | 过滤 |
| C | Na2CO3 | NaHCO3 | H2O | 溶解、过滤 |
| D | Fe | Al | NaOH溶液 | 过滤 |
根据下列实验内容得出的结论正确的是
| 选项 | 实验内容 | 结论 |
| A | 某气体的水溶液能使红色石蕊试纸变蓝 | 该气体一定是NH3 |
| B | 某气体能使紫色的酸性高锰酸钾溶液褪成无色 | 该气体一定是SO2 |
| C | 某物质的水溶液中加入盐酸产生能使澄清石灰水变浑浊的无色气体 | 该溶液一定含有CO32- |
| D | 某物质的水溶液中加入BaCl2溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解 | 该溶液中至少含有SO42-、SO32-中的一种 |
以下四组气体分别与对应的试纸接触,均能使试纸变蓝的是
| 选项 | 湿润的KI淀粉试纸 | 湿润的红色石蕊试纸 |
| A | NO2 | NH3 |
| B | H2S | HCl |
| C | Cl2 | CO2 |
| D | SO2 | NH3 |