题目内容
弱电解质的电离平衡、盐类的水解平衡和难溶物的溶液平衡均属于动态平衡.(1)已知H2A在水中存在以下平衡:H2A=H++HA-,HA-?H++A2-.
①NaHA溶液______(选填“显酸性”、“显碱性”、“显中性”或“无法确定”).
②已知常温下H2A的钙盐(CaA)饱和溶液中存在以下平衡:CaA(s)?Ca2+(aq)+A2-(aq)△H>0.降低温度时,Ksp______(填“增大”、“减小”或“不变”,下同);滴加少量浓盐酸,c(Ca2+)______.
(2)已知水的电离方程式可写为2H2O?H3O++OH-,液氨类似于水的电离,则液氨的电离方程式为______;在液氨中加入NH4Cl,则平衡将向______移动(填“正向”或“逆向”).
(3)常温下,向某pH=11的Na2CO3溶液中加入过量石灰乳,过滤后所得溶液pH=13,则反应前的溶液中与反应后的滤液中水电离出的c(OH-)的比值是______.
(4)氨气溶于水得到氨水,在25℃下,将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,则用含a和b的代数式表示出该混合溶液中氨水的电离平衡常数______.
【答案】分析:(1)①根据H2A在水中的电离可知第一步完全电离,第二步部分电离,则NaHA溶液应呈显酸性;
②从影响难溶电解质的溶解平衡的角度分析;
(2)液氨的电离类似于水,根据水的电离书写;结合弱电解质的电离影响因素分析;
(3)Na2CO3溶液水解呈碱性,促进水的电离,加入过量石灰乳后生成氢氧化钙溶液,抑制水的电离;
(4)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=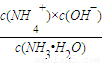 计算.
计算.
解答:解:(1)①根据H2A在水中的电离可知第一步完全电离,第二步部分电离,则NaHA溶液应呈显酸性,因HA-只电离不水解,故答案为:显酸性;
②CaA的溶解为吸热过程,降低温度向逆反应放出移动,则Ksp减小,滴加少量浓盐酸,发生H++A2-?HA-,平衡向正方向移动,则c(Ca2+)增大,故答案为:减小;增大;
(2)液氨类似于水的电离,则液氨的电离方程式为2NH3?NH2-+NH4+,在液氨中加入NH4Cl,NH4+浓度增大,则平衡将向逆向移动,故答案为:2NH3?NH2-+NH4+;逆向;
(3)Na2CO3溶液水解呈碱性,促进水的电离,水电离出的c(OH-)为1×10-3mol/L,加入过量石灰乳后生成氢氧化钙溶液,抑制水的电离,水电离出的c(OH-)为1×10-13mol/L,则比值是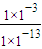 =1×1010,
=1×1010,
故答案为:1×1010;
(4)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=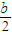 mol/L,混合后反应前c(NH3?H2O)=
mol/L,混合后反应前c(NH3?H2O)=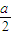 mol/L,则反应后c(NH3?H2O)=(
mol/L,则反应后c(NH3?H2O)=(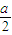 -
-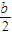 )mol/L,
)mol/L,
则k= =
=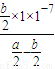 =
=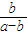 ×10-7,
×10-7,
故答案为: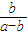 ×10-7.
×10-7.
点评:本题考查较为综合,涉及弱电解质的电离,难溶电解质的溶解平衡以及电离常数的计算,本题难点为(4),注意把握电离平衡常数的计算公式的运用,题目难度中等.
②从影响难溶电解质的溶解平衡的角度分析;
(2)液氨的电离类似于水,根据水的电离书写;结合弱电解质的电离影响因素分析;
(3)Na2CO3溶液水解呈碱性,促进水的电离,加入过量石灰乳后生成氢氧化钙溶液,抑制水的电离;
(4)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,根据k=
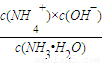 计算.
计算.解答:解:(1)①根据H2A在水中的电离可知第一步完全电离,第二步部分电离,则NaHA溶液应呈显酸性,因HA-只电离不水解,故答案为:显酸性;
②CaA的溶解为吸热过程,降低温度向逆反应放出移动,则Ksp减小,滴加少量浓盐酸,发生H++A2-?HA-,平衡向正方向移动,则c(Ca2+)增大,故答案为:减小;增大;
(2)液氨类似于水的电离,则液氨的电离方程式为2NH3?NH2-+NH4+,在液氨中加入NH4Cl,NH4+浓度增大,则平衡将向逆向移动,故答案为:2NH3?NH2-+NH4+;逆向;
(3)Na2CO3溶液水解呈碱性,促进水的电离,水电离出的c(OH-)为1×10-3mol/L,加入过量石灰乳后生成氢氧化钙溶液,抑制水的电离,水电离出的c(OH-)为1×10-13mol/L,则比值是
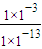 =1×1010,
=1×1010,故答案为:1×1010;
(4)将a mol?L-1的氨水与b mol?L-1的盐酸等体积混合,反应后溶液显中性,溶液中c(OH-)=1×10-7mol/L,
溶液中c(NH4+)=c(Cl-)=
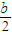 mol/L,混合后反应前c(NH3?H2O)=
mol/L,混合后反应前c(NH3?H2O)=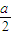 mol/L,则反应后c(NH3?H2O)=(
mol/L,则反应后c(NH3?H2O)=(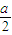 -
-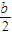 )mol/L,
)mol/L,则k=
 =
=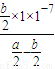 =
=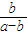 ×10-7,
×10-7,故答案为:
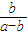 ×10-7.
×10-7.点评:本题考查较为综合,涉及弱电解质的电离,难溶电解质的溶解平衡以及电离常数的计算,本题难点为(4),注意把握电离平衡常数的计算公式的运用,题目难度中等.

练习册系列答案
 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目
 已知25℃时部分弱电解质的电离平衡常数数据如下表:
已知25℃时部分弱电解质的电离平衡常数数据如下表: