题目内容
【题目】室温下,向10mL0.1molL﹣1醋酸溶液中加水稀释后,下列说法正确的是( )
A.溶液中导电粒子的数目减少
B.再加CH3COONa固体促进醋酸的电离
C.醋酸的电离程度增大,c(H+)亦增大
D.溶液中 ![]() 不变
不变
【答案】D
【解析】解:醋酸是弱酸,在水溶液中存在电离平衡,加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)、c(CH3COOH)、c(CH3COO﹣)都减小,但温度不变,水的离子积常数不变,A.加水稀释导致溶液中c(H+)、c(CH3COO﹣)都减小,但温度不变,水的离子积常数不变,则溶液中c(OH﹣)增大,故A错误;
B.加入CH3COONa固体,c(CH3COO﹣)增大,抑制醋酸电离,平衡逆向移动,故B错误;
C.加水稀释促进醋酸电离,但醋酸电离增大程度小于溶液体积增大程度,所以溶液中c(H+)减小,故C错误;
D.溶液中 ![]() =
= ![]() .
. ![]() =
= ![]() ,温度不变,电离平衡常数和离子积常数不变,所以溶液中
,温度不变,电离平衡常数和离子积常数不变,所以溶液中 ![]() 不变,故D正确;
不变,故D正确;
故选D.
【考点精析】根据题目的已知条件,利用弱电解质在水溶液中的电离平衡的相关知识可以得到问题的答案,需要掌握当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
【题目】下表各组物质之间通过一步反应不可以实现如图所示转化关系的是
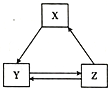
选项 | X | Y | Z |
A | NH3 | NO2 | HNO3 |
B | SiO2 | Na2SiO3 | H2SiO3 |
C | Al2O3 | NaAlO2 | Al(OH)3 |
D | CO2 | Na2CO3 | NaHCO3 |
A. A B. B C. C D. D