题目内容
短周期元素X、Y、Z、W的原子序数依次增大,X在元素周期表中原子半径最小,Y原子在周期表中处于族序数等于周期序数3倍的位置,Z是最外层电子数最少的金属元素,W与Y属于同一主族。下列叙述正确的是
A. 原子半径:W>Z>Y
B. 元素W最高价氧化物的水化物为强酸
C. 化合物X2Y、Z2Y中化学键的类型相同
D. 元素Y的简单气态氢化物的热稳定性比W的弱
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列化学现象及解释错误的是( )
选项 | 现象 | 解释 |
A | H2在Cl2中燃烧,瓶口有白雾 | 生成HCl极易溶于水 |
B | 饱和Na2CO3溶于中通入CO2析出白色晶体 | 生成NaHCO3溶解度小析出 |
C | 常温下将铝片放入浓硝酸中无明显变化 | Al和浓硝酸不反应 |
D | SO2通入溴水,溴水褪色 | SO2具有还原性 |
A. A B. B C. C D. D


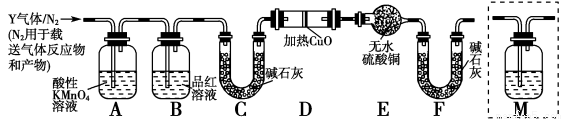
 2NH3(g),若氯气的物质的量由0.4mol降到0.24mol需2s,那么由0.24md降到0.04mol,需要的反应时间为
2NH3(g),若氯气的物质的量由0.4mol降到0.24mol需2s,那么由0.24md降到0.04mol,需要的反应时间为
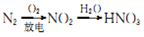

 2CA3 (g),且己知反应物总能量高于生成物总能量。
2CA3 (g),且己知反应物总能量高于生成物总能量。 键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。
键分别需要吸收的能量为a kJ、b kJ、c kJ,则按上述反应生成1molCA3的过程中的能量变化为:_________(填“吸收”或“放出”) ______kJ。