��Ŀ����
�����йص������Һ��ϵ��ȷ����
- A.�ֱ���pH=2������ʹ�����Һ�У���ˮϡ�͵�pH=4������ˮ��������
- B.�����ʵ���Ũ�ȵ��Ȼ��ƺʹ�������Һ�У�����ϵ��c(Na+)= c(Cl-)+c(CH3COO-)
- C.��NaHSO3��Һ���ɴ�С��˳��Ϊ��c(Na+)��c(HSO3-)��c(SO32-)��c(H2SO3)
- D.�����������H2A��H2B��������ʵ���Ũ�ȵ������Na2A��Na2B��Һ�У���������Ŀǰ�ߴ��ں���
���������ѡ��A������Ϊǿ�ᣬ����Ϊ���ᣬ��ˮϡ��ʱ��������ˮ�������ѡ��B������������غ��c(Na��)+c(H��)= c(Cl��)+c(CH3COO��)��ѡ��D��H2A����ǿ��H2B��B2-�����������ӽ�ϵ�����ǿ��A2-���ӣ����Na2A�ļ�������Na2B���ٸ���c(Na+)+c(H+)=c(A2-)+c(OH-) ,
c(Na+)+c(H+)=c(A2-)+c(OH-),Na+Ũ����ͬ��A�е�c(H+)����B��c(H+),�ɵ�Na2A��Һ�е�����������
���㣺������ʵĵ���ƽ�⣬�����ˮ��
����������ؼ����ڻ����������غ㣬����Һ���������ж�����Ũ�ȵĴ�С��

��������10������:
��NaHCO3����NH4HCO3����BaSO4����HF����C2H5OH����Al����ʳ��ˮ����CH3COOH�� ��HCl�� ��NaOH��
��1���������ڷǵ���ʵ���_____________������ţ���ͬ�������ܸ����ᷴӦ���ܸ�NaOH��Һ��Ӧ����_____________��
��2��NaHCO3��Һ�� �ԣ���ᡱ��������С�����ԭ���ǣ�������ӷ���ʽ��ʾ��
��
��3������ʱ��������Һ����pH=4��CH3COOH��Һ����pH=4��HCl��Һ����pH=10��NaOH��Һ������pH=10��CH3COONa��Һ������֪����ʱ����ĵ��볣��Ϊ1.75��10��5��
�����й�������ȷ���� ����������Һ���ʱ������仯��
| A������Һ�ֱ���10g���۳�ַ�Ӧ������H2������һ������ |
| B�������������Ϻ���Һ�е�c(CH3COO��)Ϊԭ��ҺŨ�ȵ�1/2 |
| C������͢�������Ϻ���ҺpHһ��С��7 |
| D��������Һ��10mL�ֱ��ˮϡ����100mL����Һ��pH����>��>��>�� |
A��B��C��D�Ƕ�����Ԫ���γɵ��������嵥�ʣ���������Ϊ�����H����Ϊ��ͨп�̸ɵ�صĵ���ʡ��йص�ת����ϵ����ͼ��ʾ����Ӧ����������ȥ����
��ش��������⣺
��1��B�ĽṹʽΪ____ ��G�Ļ�ѧʽΪ ��
��2��Y��E��һ�������¿ɷ�Ӧ����B��Z���÷�Ӧ�Ļ�ѧ����ʽΪ ��
��3�������Ϊ0.5L�ĺ����ܱ������У�����1.25molB��1.25molD�������»�ѧ��Ӧ��
B��g��+3D��g�� 2Y��g�����仯ѧƽ�ⳣ��K��T�Ĺ�ϵ���±���ʾ��
2Y��g�����仯ѧƽ�ⳣ��K��T�Ĺ�ϵ���±���ʾ��
|
T/�� |
300 |
400 |
|
K |
3.41 |
0.50 |
������Ӧ��400���½��У����и���������Ϊ�жϸ÷�Ӧ�ﵽ��ѧƽ��״̬���ݵ���
������ĸ����
A��Y��B��D�����ʵ����ֱ�Ϊ0.50mol��l.0mol��0.50mol
B��v����B��= 3v ����D��
C��������ѹǿ���ֲ���
D�����������ܶȱ��ֲ���
����һ��������B��g��+3D��g�� 2Y��g���ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ������˵������ȷ���ǣ� ��
2Y��g���ﵽƽ��״̬��ʱ��Ϊt1ʱ�ı���������ѧ��Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ������˵������ȷ���ǣ� ��
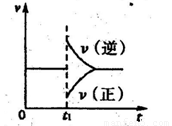
A��ά���¶ȡ���Ӧ��ϵ������䣬t1ʱ����Y��g��
B��ά��ѹǿ���䣬tlʱ���߷�Ӧ��ϵ�¶�
C��ά���¶Ȳ��䣬t1ʱ����Ӧ��ϵ���
D��ά���¶ȡ�ѹǿ���䣬t1ʱ����Y��g��
��4��0.lmol��L-1��X��Һ��0.2mol��L-1��Y��Һ�������Ϻ��Լ��ԣ���û����Һ�и�����Ũ�ȴ�С˳���� ��
��5�������£�0.1mol��L-1��Y��Һ��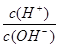 =l��10-8�����������д������ �� ��
=l��10-8���������������� �� ��
A������Һ��pH=11
B������Һ�е����ʵ������������Ũ��Ϊ0.1mol��L-1
C������Һ��ˮ�������c��H+����c��OH�����˻�Ϊl��10-22
D��pH=l��X��ҺV1L��0.1mol��L-1��Y��ҺV2L��ϣ��������ҺpH =7����V1<V2
E����0.1mol��L-1��Y��Һ��ˮϡ��100����pH >9
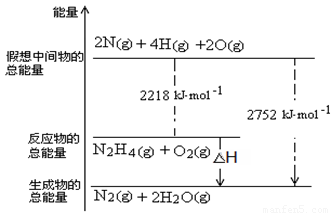
 2NH3��g����H����92.4 kJ��mol��1
2NH3��g����H����92.4 kJ��mol��1