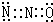题目内容
(8分)(1)在淀粉碘化钾溶液中通入少量氯气,立即会看到溶液变蓝色,这是因为_______________,反应的离子方程式是____________________。
(2)在碘和淀粉形成的蓝色溶液中通入SO 气体,发现蓝色逐渐消失,这是因为
气体,发现蓝色逐渐消失,这是因为
_____________________,反应的离子方程式是______________________。
(3)对比(1)和(2)实验所得的结果,将Cl 、I
、I 、SO
、SO 按还原性由强到弱顺序排列为____________________。
按还原性由强到弱顺序排列为____________________。
(8分)(1)I 被氧化成I
被氧化成I ,I
,I 使淀粉变成蓝色(1分)
使淀粉变成蓝色(1分)
2I +Cl
+Cl =I
=I +2Cl
+2Cl (2分) (2)I
(2分) (2)I 被SO
被SO 还原成I
还原成I (1分)
(1分)
I +SO
+SO +2H
+2H O=2I
O=2I +SO
+SO +4H
+4H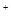 (2分)
(2分)
(3) (2分)
(2分)
解析试题分析:(1)氯气具有强氧化性,能把I 被氧化成I
被氧化成I ,I
,I 使淀粉变成蓝色,反应的离子方程式是2I
使淀粉变成蓝色,反应的离子方程式是2I +Cl
+Cl =I
=I +2Cl
+2Cl 。
。
(2)单质碘具有氧化性,能把SO2氧化生成硫酸,而碘被还原生成碘离子,反应的离子方程式是I +SO
+SO +2H
+2H O=2I
O=2I +SO
+SO +4H
+4H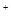 。
。
(3)由于在氧化还原反应中还原剂的还原性强于还原产物的,是以三种还原剂的还原性强弱顺序是 。
。
考点:考查氧化还原反应的有关判断、应用以及离子方程式的书写
点评:本题是高考中的常见考点,试题侧重基础性知识的考查,只要学生能够熟练记住常见物质的氧化性和还原性以及有关的反应,即可得出正确的结论。

练习册系列答案
相关题目