题目内容
在同温同压下,下列各组热化学方程式中,Q2>Q1的是( )
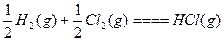 ΔH=-Q2 kJ·mol
ΔH=-Q2 kJ·mol
| A.2H2(g)+O2(g)====2H2O(g) ΔH=-Q2 kJ·mol-1; 2H2(g)+O2(g)====2H2O(l) ΔH=-Q1 kJ·mol-1 |
| B.S(g)+O2(g)====SO2(g) ΔH=-Q1 kJ·mol-1; S(s)+O2(g)====SO2(g) ΔH=-Q2 kJ·mol-1 |
C.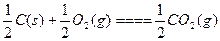 ΔH=-Q1 kJ·mol-1; ΔH=-Q1 kJ·mol-1;C(s)+O2(g)====CO2(g) ΔH=-Q2 kJ·mol-1 |
| D.H2(g)+Cl2(g)====2HCl(g) ΔH=-Q1 kJ·mol-1; |
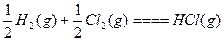 ΔH=-Q2 kJ·mol
ΔH=-Q2 kJ·molC
相同物质反应时,影响反应热大小的因素,一是物质数量的多少,二是物质状态。A、B两组属状态不同:A组中因H2O(l)H2O(g)是吸热的,所以Q1>Q2;B组中S(s)S(g)是吸热的,但因其是反应物,故Q1>Q2。C、D两组属反应物的数量不同,量多的放热多,故C正确。

练习册系列答案
相关题目

 H2SO4(aq)====
H2SO4(aq)==== Cl-
Cl-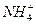 Cl-
Cl-
