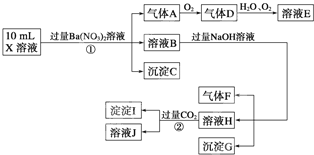
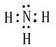题目内容
在一定条件下KClO3与I2,按下列反应:2KClO3+I2=2KIO3+Cl2,则下列推断正确的是( )
| A.该反应的电子转移数目是10e- |
| B.I2是氧化剂 |
| C.还原性Cl2>I2. |
| D.还原产物为KIO3,氧化产物为Cl2 |
2KClO3+I2=2KIO3+Cl2中,Cl元素的化合价由+5价降低为0,I元素的化合价由0升高为+5,
A.由反应可知,转移的电子数为2×(5-0)=10e-,故A正确;
B.因I元素的化合价升高,则I2为还原剂,故B错误;
C.由还原剂的还原性大于还原产物的还原性,则还原性I2>Cl2,故C错误;
D.还原产物为Cl2,氧化产物为KIO3,故D错误;
故选A.
A.由反应可知,转移的电子数为2×(5-0)=10e-,故A正确;
B.因I元素的化合价升高,则I2为还原剂,故B错误;
C.由还原剂的还原性大于还原产物的还原性,则还原性I2>Cl2,故C错误;
D.还原产物为Cl2,氧化产物为KIO3,故D错误;
故选A.

练习册系列答案
相关题目