题目内容
3.氰氨基化钙是一种重要的化工原料,其制备的化学方程式为:CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑,下列说法正确的是( )| A. | CO为氧化产物,H2为还原产物 | B. | CaCN2中含有非极性键 | ||
| C. | HCN既是氧化剂又是还原剂 | D. | 每消耗10g CaCO3生成2.24L CO2 |
分析 在CaCO3+2HCN=CaCN2+CO↑+H2↑+CO2↑反应中,HCN中的碳元素化合价由+2升高到+4,对应的氧化产物为CaCN2,HCN中的氢元素化合价由+1价降低到0,对应的还原产物为H2,以此解答该题.
解答 解:A.CO由HCN生成,C的化合价没有变化,所以CO既不是氧化产物也不是还原产物,故A错误;
B.CaCN2中存在[N=C=N]2-,含有离子键和极性键,不含非极性键,故B错误;
C.因HCN中的碳元素化合价升高,氢元素的化合价降低,则HCN既是氧化剂又是还原剂,故C正确;
D.气体存在的条件未知,没有说明是在标准状况下,所以不能确定体积大小,故D错误.
故选C.
点评 本题考查氧化还原反应,侧重于学生的分析能力的考查,注意利用元素的化合价来分析氧化还原反应,明确反应中各物质中的元素的化合价是解答的关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
4.下列物质长期露置于空气中会变质,但不是发生氧化还原反应的是( )
| A. | Na | B. | NaOH | C. | FeSO4 | D. | 氯水 |
14.下列表示对应化学反应的离子方程式正确的是( )
| A. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe2++NO↑+2H2O | |
| B. | 用铜作电极电解饱和食盐水:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$Cl2↑+H2↑+2OH- | |
| C. | 硫化钠的水解反应:S2-+H3O+?HS-+H2O | |
| D. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O |
11.下列物质中只含离子键的是( )
| A. | SO2 | B. | Na2O2 | C. | H2O2 | D. | NaC1 |
18.某有机物结构式为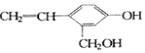 ,它不可能具有的性质是( )
,它不可能具有的性质是( )
①可以燃烧 ②能使酸性高锰酸钾溶液褪色 ③能跟KOH溶液反应 ④能发生聚合反应 ⑤能发生消去反应 ⑥能与金属钠反应 ⑦能发生取代反应 ⑧能被氧化.
 ,它不可能具有的性质是( )
,它不可能具有的性质是( )①可以燃烧 ②能使酸性高锰酸钾溶液褪色 ③能跟KOH溶液反应 ④能发生聚合反应 ⑤能发生消去反应 ⑥能与金属钠反应 ⑦能发生取代反应 ⑧能被氧化.
| A. | ⑤ | B. | ①②③④⑥⑦⑧ | C. | ①⑤⑦ | D. | ⑤⑧ |
8.下列反应中,反应物总能量低于生成物总能量的是( )
| A. | C+CO2=2CO | B. | C+O2=CO2 | C. | 2C+O2=2CO | D. | 2H2+O2=2H2O |
15.下列操作中,能使电离平衡H2O?H++OH-,向右移动且溶液呈酸性的是( )
| A. | 向水中加入NaHSO3溶液 | B. | 向水中加入NH4Cl溶液 | ||
| C. | 向水中加入CH3COONa 溶液 | D. | 将水加热到100℃,使 pH=6 |
12.W、X、Y、Z为四种短周期元素,且原子序数依次增大.W的一种核素可用于测定文物的年代,X的一种同素异形体具有漂白性且可用于自来水消毒,Y单质在X单质中燃烧生成淡黄色固体,Z的简单离子半径是同周期元素简单离子半径最小的.下列说法正确的是( )
| A. | X与Y可形成两种阴阳离子个数比相同的化合物 | |
| B. | W与X的单质可直接化合形成含有非极性键的化合物 | |
| C. | Z单质制造的容器可长时间储存碱性的食物 | |
| D. | 工业上常采用电解熔融Z的氯化物来制取单质Z |

