题目内容
(5分)有A、B、C、D、E五种元素,A元素形成的-2价阴离子比氦的核外电子数多8个。B元素的一种氧化物为淡黄色固体,该固体遇到空气能生成A的单质。C为原子核内有12个中子的二价金属,当2.4 g C与足量盐酸反应时,生成标准状况下的H2 2.24 L。D的原子M层上有7个电子,E与A同周期且最外层比次外层多3个电子。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)
(4)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子反应方程式:
。
(5)写出实验室制E的氢化物的化学反应方程式 。
(1)C离子的结构示意图 。
(2)A、E氢化物的稳定性比较 。(填化学式)
(3)A、B、C、D四种离子半径由大到小顺序 (用离子符号表示)
(4)写出Cu与E的最高价氧化物对应水化物稀溶液反应的离子反应方程式:
。
(5)写出实验室制E的氢化物的化学反应方程式 。
(1)+12 2 8 (2)H2O>NH3 (3)Cl->O2->Na+>Mg2+
(4)3Cu + 8H+ + 2NO3- ===3Cu2+ + 2NO↑ + 4H2O
(5)2NH4Cl + Ca(OH)2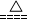 CaCl2 + 2NH3↑ + 2H2O
CaCl2 + 2NH3↑ + 2H2O
(4)3Cu + 8H+ + 2NO3- ===3Cu2+ + 2NO↑ + 4H2O
(5)2NH4Cl + Ca(OH)2
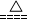 CaCl2 + 2NH3↑ + 2H2O
CaCl2 + 2NH3↑ + 2H2OA的-2价阴离子核外有10个电子,则A是氧元素;
Na2O2是淡黄色固体,则B是钠元素(2 Na2O2+2CO2=2Na2CO3+O2);
C+2H+= C2++H2↑
M(C) 22.4L
2.4g 2.24L 则M(C)=24g.mol-1
C的质子数=24-12=12,则C是镁元素;
D的核外电子排布是2 8 7,则D是氯元素;
E的核外电子排布是2 5,则E是氮元素;
(2)同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,即: O2->Na+>Mg2+,
Cl-核外电子排布是2 8 8(3层电子),O2-核外电子排布是2 8 (2电子),故:Cl->O2-;
Na2O2是淡黄色固体,则B是钠元素(2 Na2O2+2CO2=2Na2CO3+O2);
C+2H+= C2++H2↑
M(C) 22.4L
2.4g 2.24L 则M(C)=24g.mol-1
C的质子数=24-12=12,则C是镁元素;
D的核外电子排布是2 8 7,则D是氯元素;
E的核外电子排布是2 5,则E是氮元素;
(2)同周期,由左到右,原子的得电子能力逐渐增强,则气态氢化物的稳定性增强;
(3)具有相同核外电子排布的离子,原子序数越大,离子半径越小,即: O2->Na+>Mg2+,
Cl-核外电子排布是2 8 8(3层电子),O2-核外电子排布是2 8 (2电子),故:Cl->O2-;

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
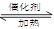 N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。
N2+H2O(方程没配平)来处理M。当转移0.4mol电子时,消耗的M在标准状况下是 L。