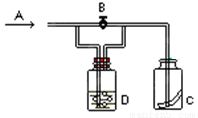
题目内容
氢化钠(NaH)是一种还原性极强的物质,广泛应用于工业生产。
(1)氢化钠(NaH)中氢元素的化合价为 。
(2)NaH能与水剧烈反应:NaH+H2O= NaOH+H2↑,该反应中的氧化剂是 。如果有12gNaH与水反应,则转移电子的个数为 。
(3)在高温下氢化钠(NaH)可将四氯化钛(TiC14)还原成金属钛,该反应的化学方程式为 。
(1)—1(共1分)
(2)H2O 3.01×1023或0.5NA(共3分;第一空1分,第二空2分)
(3)2NaH+TiCl4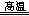 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4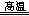 Ti+4NaCl+2H2↑(共2分)
Ti+4NaCl+2H2↑(共2分)
【解析】
试题分析:(1)化合物中钠元素为+1价,由化合价代数和为0可知,氢元素为—1价;(2)氢元素既由—1价升为0价,又由+1价降为0价,既被氧化又被还原,则 NaH是还原剂,H2O是氧化剂;由m/M可知,n(NaH)=0.5mol;由化合价升降总数为1可知,NaH~e—,则该反应转移0.5mol电子,由n?NA可知,N(e—)=3.01×1023或0.5NA;(3)钛元素由+4价降低到0价,由此推测氢元素由—1价升高为0价或+1价,由化合价升价总数相等、原子守恒可知,2NaH+TiCl4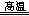 Ti+2NaCl+2HCl↑或4NaH+TiCl4
Ti+2NaCl+2HCl↑或4NaH+TiCl4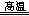 Ti+4NaCl+2H2↑。
Ti+4NaCl+2H2↑。
考点:考查元素化合价、氧化剂、物质的量、转移电子数、氧化还原反应方程式等相关知识。

 名校课堂系列答案
名校课堂系列答案某同学用物质的量之比为1∶1的NaNO3和KCl的混合物进行实验:在10℃时,将混合物逐渐加入到烧杯中的水中,一边加一边搅拌。根据下表四种盐在10℃时的溶解度进行判断,上述实验过程中最先析出的晶体是
| NaNO3 | KNO3 | NaCl | KCl |
溶解度(g) | 80.5 | 20.9 | 35.7 | 31.0 |
A.NaNO3 B.KNO3 C.NaCl D.KC1