��Ŀ����
�����£���amolN2��bmolH2�Ļ������ͨ��һ���̶��ݻ����ܱ������У��������·�Ӧ��N2(g)+3H2(g)![]() 2NH3(g)
2NH3(g)
(1)����Ӧ���е�ijʱ��tʱn1(N2)=13mol,n1(NH3)=6moL,����a= ��
��2����Ӧ��ƽ��ʱ�������������Ϊ716.8L������£�������NH3���������Ϊ25%����ƽ��ʱNH3�����ʵ���Ϊ ��
(3)ԭ���������ƽ��������������ʵ���֮��Ϊ��д�����������,��ͬ�� ��
��4��ԭ��������У�a:b= ��
��5����ƽ��ʱ��N2��H2��ת����֮��Ϊ ��
��6��ƽ���������У�n(N2):n(H2):n(NH3)= ��
(1)16 (2)8mol (3)5:4 (4)2:3 (5)1:2 (6)3:3:2

��ϰ��ϵ�д�
 ��ʦָ����ĩ��̾�ϵ�д�
��ʦָ����ĩ��̾�ϵ�д� �����ܿ����ϵ�д�
�����ܿ����ϵ�д�
�����Ŀ
 2NH3��g��
2NH3��g�� 2NH3��g��
2NH3��g��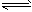 2NH3��g��
2NH3��g��