题目内容
(09盐城第三次调研)氯化铁是常见的水处理剂,无水FeCl3的熔点为555K、沸点为588K。工业上制备无水FeCl3的一种工艺如下:
(1)取0.5mL三氯化铁溶液滴入50mL沸水中,再煮沸片刻得红褐色透明液体,该过程可用离子方程式表示为: 。
(2)已知六水合氯化铁在水中的溶解度如下:
温度/℃. | 0 | 10 | 20 | 30 | 50 | 80 | 100 |
溶解度(g/100gH20) | 74.4 | 81.9 | 91.8 | 106.8 | 315.1 | 525.8 | 535.7 |
从FeCl3溶液中获得FeCl3?6H2O的方法是: 。
(3)捕集器中温度超过673K,存在相对分子质量为325的物质,该物质的分子式为: 。
(4)室温时在FeCl3溶液中滴加NaOH溶液,当溶液pH为2.7时,Fe3+开始沉淀;当溶液pH为4时,c(Fe3+)= mol/L(已知:Ksp[Fe(OH)3]= 1.1×10-36)。
(5)吸收剂X是: ;吸收塔中吸收剂X的作用是: 。
(6)FeCl3的质量分数通常可用碘量法测定:称取mg无水氯化铁样品,溶于稀盐酸,再转移到100mL容量瓶,用蒸馏水定容;取出10.00mL,加入稍过量的KI溶液,充分反应后,用淀粉作指示剂并用cmol/LNa2S2O3溶液滴定(I2+2S2O32-=2I- +S4O62-),共用去VmL。则样品中氯化铁的质量分数为: 。
(2)加入少量盐酸加热浓缩,再冷却结晶(1分)
(3)Fe2Cl6 (1分)
(4)1.1×10-6 (2分)
(5)FeCl2溶液(1分); 吸收反应炉中过量的氯气和少量氯化铁烟气(1分)。
(6)162.5Vc/m % (2分)

(09盐城第三次调研)今有X、Y、Z三种有机物(其相对分子质量均小于100),它们含碳、氢、氧、氮4种元素中的三种或四种。有一合作学习小组的同学拟确定它们的组成或结构。
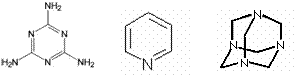
(1)测定有机物相对分子质量所用的方法通常是 (填序号,下同。①红外光谱,②质谱,③氢核磁共振谱,④
元素分析);下列物质的氢核磁共振谱只有一个吸收峰的是:
![]()
![]()
![]()
![]()
![]()
![]() (① 新戊烷, ② , ③ , ④ )
(① 新戊烷, ② , ③ , ④ )
![]()
![]() (2)X由C、H、O、N四种元素组成,ω(N)=18.67%,且X既能与盐酸反应又能与氢氧化钠溶液反应,则X可能的结构简式为: 。
(2)X由C、H、O、N四种元素组成,ω(N)=18.67%,且X既能与盐酸反应又能与氢氧化钠溶液反应,则X可能的结构简式为: 。
(3)Y和Z的相对分子质量相等,它们完全燃烧时,只能生成CO2、H2O、N2中的两种或三种。某同学取一定量的Y和Z的混合物,完全燃烧时在标准状况下的实验结果如下:
实验序号 | 混合物 质量 | 物质的量关系n(Y)/n(Z) | 产物的量 | ||
m(CO2)/g | m(H2O)/g | V(N2)/mL | |||
① | 3g | 2∶3 | 3.08 | 1.8 | 672 |
② | 3g | 3:2 | 3.52 | 1.8 | 448 |

 )
)