题目内容
【题目】甲酸铝广泛用于化工、石油等生产上,120150℃左右分解。在0℃时,溶解度为16g,100℃时,溶解度为18.4g。
首先用废铝渣制取AI(OH)3固体,流程如下:
![]()
(1)调节pH用_________试剂为好。某同学在减压过滤时,布氏漏斗内没有得到产品,可能原因是______________________。
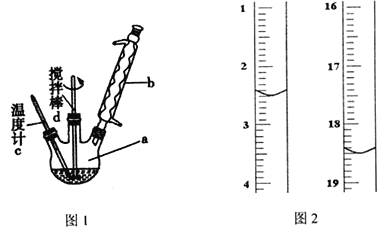
然后将氢氧化铝和甲醛依次加入到质量分数为50%的过氧化氢溶液中(投料物质的量之比依次为1∶3∶2),装置如图1.最终可得到含甲酸铝90%以上的优质产品。反应式为:2Al(OH)3+6HCHO+3H2O2=2Al(HCOO)3+6H2O+3H2↑。
(2)反应过程可看作两步进行,第一步______________(写出化学方程式),第二步为甲酸与Al(OH)3 反应生成甲酸铝。
(3)反应温度最好控制在30—70℃之间,温度不宜过高,主要原因是_________________。
(4)实验时需强力搅拌45 min,最后将溶液____________,抽滤,洗涤,干燥得产品。可用酸性KmnO4标准溶液滴定法来测定产品纯度,滴定起始和终点的滴定管液面位置见上图2, 则消耗的酸性KmnO4标准溶液体积为__________________mL。
【答案】 氨水 生成的Al(OH)3 呈胶状沉淀 2HCHO+H2O2=2HCOOH+H2↑ 防止H2O2分解及HCHO挥发 蒸发结晶 16.00
【解析】试题分析:(1)氢氧化铝易溶于强碱,难溶于弱碱,为减少氢氧化铝的损失,选用弱碱;氢氧化铝胶体能透过滤纸;(2)根据题意,第一步反应为甲醛被氧化为甲酸;(3)温度过高H2O2分解速率加快、HCHO挥发速度加快;(4)甲酸铝的溶解度受温度影响不大,获得晶体的方法是蒸发溶剂;滴定开始液面读数是2.50,滴定结束液面读数是18.50。
解析:(1)氢氧化铝易溶于强碱,难溶于弱碱,为减少氢氧化铝的损失,调节pH用氨水为好;氢氧化铝胶体能透过滤纸,生成的Al(OH)3 呈胶状沉淀布氏漏斗内没有得到产品;(2)根据题意,第一步反应为甲醛被过氧化氢氧化为甲酸,方程式为2HCHO+H2O2=2HCOOH+H2↑;(3)温度过高H2O2分解速率加快、HCHO挥发速度加快;(4)甲酸铝的溶解度受温度影响不大,获得晶体的方法是蒸发结晶;滴定开始液面读数是2.50,滴定结束液面读数是18.50,消耗的酸性KmnO4标准溶液体积为16.00 mL。

【题目】某研究性学习小组在网上收集到信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
【实验】将燃烧的钠迅速伸入盛满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出假设】
假设1:白色物质是Na2O
假设2:白色物质是Na2CO3
假设3:白色物质是Na2O和Na2CO3的混合物
【设计实验方案·验证假设】该小组对燃烧后的白色产物进行如下探究:
实验操作 | 实验现象 | 结论 | |
方案1 | 取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | 溶液变成红色 | 白色物质为Na2O |
方案2 | ①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 出现白色沉淀 | |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | 无明显现象 |
【思考与交流】
(1)甲同学认为方案1得到的结论不正确,其理由是:_________。
(2)通过方案1和方案2的实验,你认为上述三个假设中,__________成立。
(3)钠在二氧化碳中燃烧的化学方程式为:____________________________。
(4)丙同学认为白色物质有可能是氢氧化钠,你是否同意丙同学的观点,并简述理由:__________________________________。
