题目内容
【题目】某同学设计了甲烷燃料电池并探究某些工业电解原理(如图所示),其中乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),丙装置为探究粗铜精炼原理。请回答下列问题:
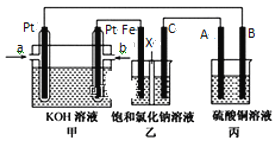
(1)从 b口通入的气体发生的电极反应为______________________________。
(2)写出乙中发生的总反应的离子方程式为________________________________。
(3)当b口消耗标况下2.24L的气体时,则A极增重质量为__________________
【答案】CH4+10OH--8e-=CO32-+7H2O 2Cl-+2H2O Cl2↑+H2↑+2OH- 12.8g
Cl2↑+H2↑+2OH- 12.8g
【解析】
(1)乙装置为探究氯碱工业原理(X为阳离子交换膜,C为石墨电极),则Fe作阴极、碳作阳极,所以通入a的电极材料是正极、通入b的电极为负极;
(2)乙中阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子;
(3)根据串联电池中转移电子数相等计算丙装置中析出铜的质量。
(1)根据分析可知通入b的电极为负极,甲烷燃料电池中负极通入甲烷,所以电极方程式为:CH4+10OH--8e-=CO32-+7H2O.故答案为:CH4+10OH--8e-=CO32-+7H2O;
(2)乙中阳极上氯离子放电生成氯气,阴极上水得电子生成氢气和氢氧根离子,则电池反应式为2Cl-+2H2O Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O
Cl2↑+H2↑+2OH-,故答案为:2Cl-+2H2O Cl2↑+H2↑+2OH-;
Cl2↑+H2↑+2OH-;
(3)串联电池中转移电子数相等,若在标准状况下,有2.24L氧气参加反应,则转移电子的物质的量=![]() =0.4mol,A极发生反应2Cu 2++2e-=Cu,转移0.4mol电子时生成Cu的物质的量为0.2mol,质量为0.2mol×64g/mol=12.8g,故答案为:12.8g。
=0.4mol,A极发生反应2Cu 2++2e-=Cu,转移0.4mol电子时生成Cu的物质的量为0.2mol,质量为0.2mol×64g/mol=12.8g,故答案为:12.8g。

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案【题目】高炉炼铁过程中发生反应:![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g) ![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见表。
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
下列说法正确的是
A. 增加高炉的高度可以有效降低炼铁尾气中CO的含量
B. 由表中数据可判断该反应:反应物的总能量>生成物的总能量
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO表示该反应的平均速率为![]() mol/(L·min)
mol/(L·min)


