题目内容
下列框图中的每一个字母都是中学化学中常见的物质,所有物质均由短周期元素组成,其中B、C、G、K、L都含有同一种元素.B、E、F、I为单质.常温常压下D为液体,E、F、I为气体,F是空气的主要成分之一.C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽.这些物质之间有可能发生如下转化,其反应关系如图所示:
(1)写出A的电子式______,B的原子结构示意图______,D的结构式是______E在I中燃烧的现象为______.
(2)25°C,101kPa下,2gE完全燃烧放出285.8kJ的热量,写出E+F→D的热化学反应方程式______.
(3)铂做电极E与F、KOH溶液构成原电池,其负极反应为______;如果将通入的E改成CH4气体,也可以组成一个原电池装置,电池的总反应方程式为:CH4+2O2+2KOH=K2CO3+3H2O,则该电池的负极反应式为:______.
(4)如图所示,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为______,______.
(5)K+G═L的离子方程式为______.
解:由“D常温常压为液体,EF为气体,F是空气的主要成份之一.”可推出F为O2,E为H2,D为H2O,A与B跟水能反应生成氢气和氧气,由过氧化物能与水反应生成O2,则A与B可能是Na2O2,生成物中有NaOH,Al与NaOH反应生成H2与NaAlO2,推出B为单质Al,A为Na2O2,C为Al2O3,D为H2O,E为H2,F为O2,G为NaAlO2,H为NaOH,检查一下,B、C、G都含有同一种元素为铝,C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽为Al2O3,L为Al(OH)3,K为AlCl3,J为HCl,则I为
Cl2,
(1)A为Na2O2,为离子化合物,电子式为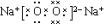 ,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为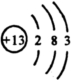 ,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾,
,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾,
故答案为: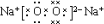 ;
;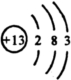 ;H-O-H; 苍白色火焰(产生白雾);
;H-O-H; 苍白色火焰(产生白雾);
(2)已知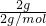 =1molH2完全燃烧放出285.8kJ的热量,则在反应2H2(g)+O2(g)=2H2O(l)中,△H=2×(-285.8kJ/mol)=-571.6kJ?mol-1,所以有2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1,
=1molH2完全燃烧放出285.8kJ的热量,则在反应2H2(g)+O2(g)=2H2O(l)中,△H=2×(-285.8kJ/mol)=-571.6kJ?mol-1,所以有2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1,
故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1;
(3)碱性氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,碱性甲烷燃料电池中,通入甲烷的一极为电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:H2-2e-+2OH-=2H2O;CH4+10OH--8e-=CO32-+7H2O;
(4)A为Na2O2,C为Al2O3,D为H2O,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Al2O3+2NaOH=2NaAlO2+H2O;
(5)K为AlCl3,G为NaAlO2,二者能发生互促水解反应生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
分析:由“D常温常压为液体,EF为气体,F是空气的主要成份之一.”可推出F为O2,E为H2,D为H2O,A与B跟水能反应生成氢气和氧气,由过氧化物能与水反应生成O2,则A与B可能是Na2O2,生成物中有NaOH,铝与NaOH反应生成H2与NaAlO2,推出B为单质Al,A为Na2O2,C为Al2O3,D为H2O,E为H2,F为O2,G为NaAlO2,H为NaOH,B、C、G都含有同一种元素为铝,C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽为Al2O3,L为Al(OH)3,K为AlCl3,J为HCl,则I为Cl2,结合对应单质化合物的性质解答该题.
点评:本题考查无机物的推断,题目难度较大,解答本题的关键是正确推断物质的种类,推断时,要根据反应的典型现象以及物质的特殊性质作为突破口,学习中注重相关知识的积累.
Cl2,
(1)A为Na2O2,为离子化合物,电子式为
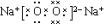 ,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为
,B为单质Al,核电荷数为13,原子核外有3个电子层,最外层电子数为3,原子结构示意图为 ,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾,
,1个水分子中含有2个氢氧共价键,结构式为H-O-H,氢气在氯气中燃烧,产生苍白色火焰,生成的HCl易溶于水,能产生白雾,故答案为:
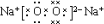 ;
; ;H-O-H; 苍白色火焰(产生白雾);
;H-O-H; 苍白色火焰(产生白雾);(2)已知
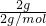 =1molH2完全燃烧放出285.8kJ的热量,则在反应2H2(g)+O2(g)=2H2O(l)中,△H=2×(-285.8kJ/mol)=-571.6kJ?mol-1,所以有2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1,
=1molH2完全燃烧放出285.8kJ的热量,则在反应2H2(g)+O2(g)=2H2O(l)中,△H=2×(-285.8kJ/mol)=-571.6kJ?mol-1,所以有2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1,故答案为:2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ?mol-1;
(3)碱性氢氧燃料电池中,通入氢气的一极为电池的负极,发生氧化反应,电极反应式为H2-2e-+2OH-=2H2O,碱性甲烷燃料电池中,通入甲烷的一极为电池的负极,发生氧化反应,电极反应式为CH4+10OH--8e-=CO32-+7H2O,
故答案为:H2-2e-+2OH-=2H2O;CH4+10OH--8e-=CO32-+7H2O;
(4)A为Na2O2,C为Al2O3,D为H2O,A与C两种固体混合后,加入液体D,可能发生反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑,Al2O3+2NaOH=2NaAlO2+H2O,
故答案为:2Na2O2+2H2O=4NaOH+O2↑;Al2O3+2NaOH=2NaAlO2+H2O;
(5)K为AlCl3,G为NaAlO2,二者能发生互促水解反应生成Al(OH)3,反应的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,
故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓.
分析:由“D常温常压为液体,EF为气体,F是空气的主要成份之一.”可推出F为O2,E为H2,D为H2O,A与B跟水能反应生成氢气和氧气,由过氧化物能与水反应生成O2,则A与B可能是Na2O2,生成物中有NaOH,铝与NaOH反应生成H2与NaAlO2,推出B为单质Al,A为Na2O2,C为Al2O3,D为H2O,E为H2,F为O2,G为NaAlO2,H为NaOH,B、C、G都含有同一种元素为铝,C由两种元素组成,其晶体熔点高、硬度大,闪烁着晶莹的光泽为Al2O3,L为Al(OH)3,K为AlCl3,J为HCl,则I为Cl2,结合对应单质化合物的性质解答该题.
点评:本题考查无机物的推断,题目难度较大,解答本题的关键是正确推断物质的种类,推断时,要根据反应的典型现象以及物质的特殊性质作为突破口,学习中注重相关知识的积累.

练习册系列答案
相关题目




