题目内容
【题目】运用化学反应原理研究氮、氯、碘等单质及其化合物的反应有重要意义。
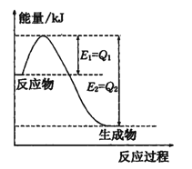
(1)如图是一定的温度和压强下N2和H2反应生成lmolNH3过程中能量变化示意图,请写出工业合成氨的热化学方程式____________(△H的数值用含字母Q1、Q2的代数式表示):
(2)已知:25℃时KSP(AgCl)=1.6×l0-10KSP(AgI)=1.5×l0-16
海水中含有大量的元素,常量元素如氯,微量元素如碘,其在海水中均以化合态存在。在25℃下,向0.1L0.002mol·L-l的NaCl溶液中逐滴加入适量的0.1L0.002mol·L-l硝酸银溶液,有白色沉淀生成,从难溶电解质的溶解平衡角度解释产生沉淀的原因是 ,向反应后的浑浊液中继续加入0.1L0.002mol·L-1的NaI溶液,看到的现象是 ,产生该现象的原因是(用离子方程式表示) 。
(3)氨气溶于水得到氨水。在25℃下,将a mol·L-1的氨水与b mol·L-1的盐酸等体积混合(混合后体积为混合前体积之和),反应后溶液显中性。求25℃下该混合溶液中氨水的电离平衡常数。
【答案】(1)N2(g)+3H2(g)![]() 2NH3(g)△H=2(Q1-Q2)kJ·mol-1;
2NH3(g)△H=2(Q1-Q2)kJ·mol-1;
(2)c(Ag+)·c(Cl-)>Ksp(AgCl),白色沉淀转化为黄色沉淀;AgCl(s)+I-(aq)=AgI(s)+Cl-(aq);
(3)b×10-7/(a-b)。
【解析】
试题分析:(1)根据能量变化示意图,反应物的总能量大于生成物的总能量,说明反应是放热反应,热化学反应方程式为:N2 (g) + 3H2(g) ![]() 2NH3(g) △H=2(Q1-Q2) kJ·mol-1;(2)根据Qc>Ksp,说明有沉淀产生,Qc=Ksp,说明此溶液为饱和溶液,Qc<Ksp,说明溶液是不饱和溶液,产生沉淀,说明c(Ag+)·c (Cl-)=1×10-6>Ksp(AgCl) =1.6×10-10,Ksp(AgI)<Ksp(AgCl),说明AgI比AgCl更难溶,因此白色沉淀转化为黄色沉淀;AgCl(s) + I-(aq)= AgI(s) + Cl-(aq);(3)因为反应后溶液呈中性,所以氨水过量,c(H+)+ c(NH4+) = c(OH-)+ c(Cl-) ,c(NH3·H2O)= (a×1-b×1)/2mol·L-1=(a-b)/2mol·L-1, c(OH-)=c(H+)=1×10-7 mol·L-1,c(NH4+)=c(Cl-)=b/2 mol·L-1,NH3·H2O
2NH3(g) △H=2(Q1-Q2) kJ·mol-1;(2)根据Qc>Ksp,说明有沉淀产生,Qc=Ksp,说明此溶液为饱和溶液,Qc<Ksp,说明溶液是不饱和溶液,产生沉淀,说明c(Ag+)·c (Cl-)=1×10-6>Ksp(AgCl) =1.6×10-10,Ksp(AgI)<Ksp(AgCl),说明AgI比AgCl更难溶,因此白色沉淀转化为黄色沉淀;AgCl(s) + I-(aq)= AgI(s) + Cl-(aq);(3)因为反应后溶液呈中性,所以氨水过量,c(H+)+ c(NH4+) = c(OH-)+ c(Cl-) ,c(NH3·H2O)= (a×1-b×1)/2mol·L-1=(a-b)/2mol·L-1, c(OH-)=c(H+)=1×10-7 mol·L-1,c(NH4+)=c(Cl-)=b/2 mol·L-1,NH3·H2O ![]() NH4++ OH-,Ksp=c(NH4+)×c(OH-)/c(NH3·H2O)=b/2×1×10-7/(a-b)/2= b×10-7/(a-b)。
NH4++ OH-,Ksp=c(NH4+)×c(OH-)/c(NH3·H2O)=b/2×1×10-7/(a-b)/2= b×10-7/(a-b)。