题目内容
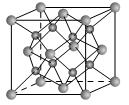
某离子晶体的晶胞如图所示,X原子位于立方体的顶点,Y原子位于立方体的中心。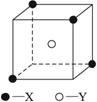
(1)该晶体的化学式为___________。
(2)晶体中每个Y原子同时吸引着___________个X,每个X原子同时吸引着___________个Y原子。
(3)晶体中在每个X原子周围与它最接近且距离相等的X原子共有___________个。
解析:(1)晶胞独占位于立方体内部的Y原子,完全占有的Y原子的个数为1。晶胞占有位于立方体顶点的X原子的![]() ,完全占有的X原子的个数为4×
,完全占有的X原子的个数为4×![]() =0.5。综合以上分析,可得该晶体的化学式为Y2X。 (2)观察晶胞即可看出每个Y同时吸引着4个X。8个晶胞以立方体顶点某一X原子为中心能并置堆砌为上下两层,选定的X原子吸引着上层的4个Y原子和下层的4个Y原子,总计同时吸引着8个Y原子。(3)将8个晶胞以立方体顶点某一X原子为中心能并置堆砌为上下两层时,与选定的X原子最接近且距离相等的X原子有上、中、下三层,每一层都是4个X原子,总计12个X原子。
=0.5。综合以上分析,可得该晶体的化学式为Y2X。 (2)观察晶胞即可看出每个Y同时吸引着4个X。8个晶胞以立方体顶点某一X原子为中心能并置堆砌为上下两层,选定的X原子吸引着上层的4个Y原子和下层的4个Y原子,总计同时吸引着8个Y原子。(3)将8个晶胞以立方体顶点某一X原子为中心能并置堆砌为上下两层时,与选定的X原子最接近且距离相等的X原子有上、中、下三层,每一层都是4个X原子,总计12个X原子。
答案:(1)Y2X (2)4 8 (3)12

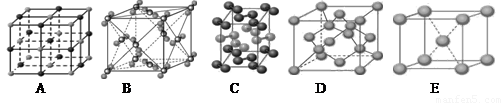
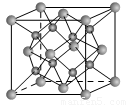
(13分)(1)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)

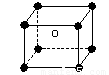
(2)一种离子晶体的晶胞如图。其中阳离子A以![]() 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。 若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。 若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
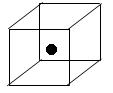
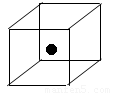
(3)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
| 化学键 | Si—Cl | H—H | H—Cl | Si—Si |
| 键能/kJ·mol—1 | 360 | 436 | 431 | 176 |
已知:工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g)高温 Si(s) + 4 HCl(g)
则该反应的反应热△H = kJ/mol.
(13分)(1)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是__ ___(请用相应的编号填写)
(2)一种离子晶体的晶胞如图。其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。 若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。 若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)下图立方体中心的“●”表示硅晶体中的一个原子,请在立方体的顶点用“●”表示出与之紧邻的硅原子。
(4)通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可以衡量化学键的强弱,也可用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
Si—Cl |
H—H |
H—Cl |
Si—Si |
|
键能/kJ·mol—1 |
360 |
436 |
431 |
176 |
已知:工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) 高温 Si(s) + 4 HCl(g)
则该反应的反应热△H = kJ/mol.
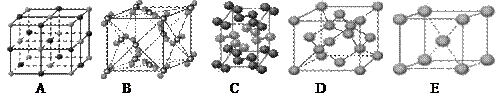
 表示,阴离子B以
表示,阴离子B以 表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;
表示。则每个晶胞中含A离子的数目为________,含B离子数目为________。若A的核外电子排布与Ar相同,B的核外电子排布与Ne相同,则该离子化合物的化学式是___________________;