题目内容
2012年6月25日,河南省科学院宣布,用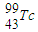 给低产油田作“钡透”,能实现原油的增产增收.下列有关
给低产油田作“钡透”,能实现原油的增产增收.下列有关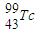 的说法中正确的是( )
的说法中正确的是( )A.
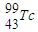 与
与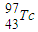 互为同素异形体
互为同素异形体B.
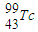 含有43个中子
含有43个中子C.
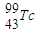 与
与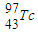 的物理性质、化学性质均相同
的物理性质、化学性质均相同D.
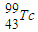 的中子数比电子数多13
的中子数比电子数多13B.中子数=质量数-质子数;
C.同位素的物理性质不同;
D.质子数=核外电子数.
解答:解:A.
 与
与 互为同位素,故A错误;
互为同位素,故A错误; B.中子数=质量数-质子数=99-43=56,故B错误;
C.同位素的物理性质可以不同,但化学性质几乎相同,故C错误;
D.中子数=质量数-质子数=99-43=56;质子数=核外电子数=43;56-43=13,故D正确.
故选D.
点评:本题考查质量数与质子数、中子数之间的相互关系,难度不大,注意中子数=质量数-质子数.

 特高级教师点拨系列答案
特高级教师点拨系列答案 文敬图书课时先锋系列答案
文敬图书课时先锋系列答案X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
|
元素代号 |
相关信息 |
|
X |
它的一种核素的原子核内没有中子 |
|
Y |
能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素 |
|
Z |
基态原子的最外层电子排布式为nsnnpn+1 |
|
W |
与钾元素能组成多种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞” |
|
T |
主要化合价有+1和+2价,且[T(X2W)4]2+和[T(ZX3)4]2+均呈蓝色 |
请推出具体元素,用具体元素回答下列问题:
(1)根据元素周期律可以设计出多种形式的周期表,下列是扇形元素周期表:
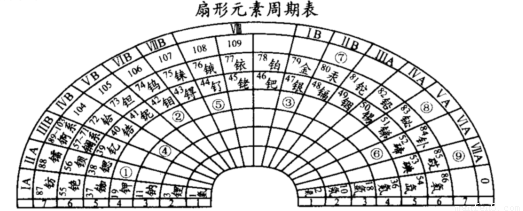
T元素在扇形元素周期表中的位置是 (填表中带圆圈的数字);上表中⑨号位置 的元素基态原子未成对电子数为 ;2012年6月25日,俄罗斯杜布纳核联合研究所再次成功合成117号元素,它将被列入元素周期表,“117”元素在扇形元素周期表中的位置是 (填表中带圆圈的数字)。
(2)质量数为2的X基态原子的电子排布式为 ,在这五种元素中电负性最大的是 。
(3)由上述五种元素中的某些元素形成的离子,该离子中每个原子最外层均有8个电子且 与Z3-具有相同质子数和电子数,则这种离子的结构式为 。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式: 。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
YZ-
(aq)+X3W+(aq) ΔH=+45.6 KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH=-57.3 KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子厅程式表示): 。