题目内容
从下列事实所列出的相应结论正确的是
| | 实 验 事 实 | 结 论 |
| A | Cl2的水溶液可以导电 | Cl2是电解质 |
| B | SO2通入硝酸钡溶液出现白色沉淀 | BaSO3不溶于强酸 |
| C | NaHCO3溶液与NaAlO2溶液混合产生白色沉淀 | 结合H+的能力:CO32-<AlO2- |
| D | 常温下白磷可自燃而氮气须在放电时才与氧气反应 | 非金属性:P>N |
C
解析试题分析:A、Cl2的水溶液可以导电,因氯气与水反应生成电解质,电解质发生电离,而氯气为单质,电解质必须为化合物,则氯气既不是电解质也不是非电解质,故A错误;B、SO2具有还原性,通入硝酸钡溶液发生氧化还原反应生成硫酸钡,故B错误;C、NaHCO3溶液与NaAlO2溶液混合,碳酸氢根离子提供氢离子与偏铝酸根反应生成Al(OH)3,说明AlO2-结合H+的能力比CO32-强,故C正确;D、非金属性是指元素原子得电子的能力,非金属性N>P,氮气须在放电时才与氧气反应,是由于分子中N≡N三键键能大,很难被破坏,所以于氮气性质稳定,故D错误。
考点:考查物质的性质、氧化还原反应、电解质概念、弱酸相对强弱的比较、元素非金属强弱比较等内容。

练习册系列答案
 培优三好生系列答案
培优三好生系列答案 优化作业上海科技文献出版社系列答案
优化作业上海科技文献出版社系列答案
相关题目
下列事实能用同一原理解释的是
| A.Na2O2和活性炭均能使品红溶液褪色 |
| B.对碘晶体和碳酸氢铵晶体加热,晶体均会逐渐消失 |
| C.SO2能使滴加酚酞的NaOH溶液和酸性KMnO4溶液的红色都褪去 |
| D.实验室配制FeC13溶液和SnC12溶液时,先将固体FeC13和SnCl2分别溶解在浓盐酸中,再加蒸馏水稀释 |
下表所列各组物质中,物质之间通过一步反应不能实现如图所示转化的是( )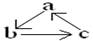
| 选项 | a | b | c |
| A | Fe | FeCl3 | FeCl2 |
| B | HNO3 | NO | NO2 |
| C | Al(OH)3 | NaAlO2 | Al2O3 |
| D | NaOH | NaHCO3 | Na2CO3 |
下列事实能用同一原理解释的是:
| A.SO2和Cl2都能用于漂白 |
| B.I2、NH4Cl晶体受热都逐渐消失 |
| C.配制Fe(NO3)3和Sn(NO3)2溶液均要加入稀硝酸 |
| D.SO2可使加酚酞的氢氧化钠溶液和酸性高锰酸钾溶液的红色都褪去 |
用酒精灯加热下列溶液,蒸干后灼烧,所得固体质量最大的是( )
| A.20 mL 2 mol/L FeCl3溶液 | B.40 mL 1 mol/L NaHCO3溶液 |
| C.20 mL 1 mol/L Na2SO3溶液 | D.40 mL 2 mol/L NH4HCO3溶液 |
甲、乙、丙、丁四种物质之间存在如图所示转化关系,且甲、乙、丙均含有相同的某种元素。
下列推断错误的是
| A.若甲为焦炭,则丁可能是O2 |
| B.若甲为N2,则丙可能是NO2 |
| C.若甲为Cl2,则丁可能是Fe |
| D.若甲为NaOH溶液,则丁可能是CO2 |
下列有关物质性质和用途的说法,正确的是
| A.光导纤维具有很强的导电能力,所以大量用于制造通信光缆 |
| B.明矾常用作净水剂,是因为它具有消毒杀菌的作用 |
| C.氨常用作制冷剂,是因为其沸点极低,很容易液化 |
| D.SiCl4在战争中常用作烟雾弹,是因为它水解时生成白色烟雾 |
