题目内容
【题目】下列反应中亚硫酸表现的性质,其中一种与另外三种不同的是( )
A.能使酸性高锰酸钾褪色B.在空气中易被氧化变质
C.能使溴水褪色D.在溶液中加入氢氧化钡溶液产生白色沉淀
【答案】D
【解析】
A、能使酸性高锰酸钾溶液褪色,是亚硫酸的还原性;
B、在空气中久置,亚硫酸被氧化成硫酸,溶液pH变小,是亚硫酸的还原性;
C、能使溴水褪色,是亚硫酸的还原性;
D、加入氢氧化钡溶液产生白色沉淀,是发生了酸碱中和反应生成了难溶性的亚硫酸钡,不是亚硫酸的还原性,与其他三种不同;
答案选D。

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案【题目】回答下列问题:
(1)若金属钠等活泼金属着火时,应该用_______________来灭火。将一小块钠投入盛有饱和石灰水的烧杯中,不可能观察到的现象是________。
a.有气体生成 b.钠熔化成小球并在液面上游动
c.烧杯底部有银白色的金属钙生成 d.溶液变浑浊
(2)Na2CO3和NaHCO3是两种常见的钠盐。下列关于Na2CO3和NaHCO3性质的说法中,正确的是______________。
a.常温下,Na2CO3在水中的溶解度比NaHCO3小
b.相同质量的Na2CO3和NaHCO3分别与足量盐酸反应,在相同条件下产生CO2前者多
c.可用Ca(OH)2溶液鉴别Na2CO3溶液和NaHCO3溶液
d. NaHCO3溶液中混有少量Na2CO3杂质可通入足量CO2除杂
(3)过氧化钠、过氧化镁都是重要的过氧化物。过氧化镁不溶于水,但易溶于稀酸,广泛用作胃药,治疗胃酸过多。试写出过氧化镁与胃酸反应的离子方程式:_____________。
(4)某无色稀溶液X中,可能含有Al3+、Cl-、Fe3+、Mg2+、NH4+中的某几种,向其中加入NaOH溶液时产生沉淀的物质的量(n)与加入NaOH溶液体积(V)的关系如下图所示。
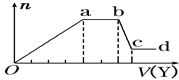
则X中一定含有的阳离子是_________,bc段反应的离子方程式为________。
(5)在1L某酸性溶液中离子浓度的分析结果如下表
离子 | Mg2+ | Al3+ | SO42 | Cl |
c/(mol/L) | 0.5×102 | 1.0×102 | 0.5×102 | 3.0×102 |
向该溶液中逐滴加入0.5 molL-1NaOH溶液至沉淀恰好不再溶解时,消耗NaOH体积为_____mL。