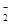题目内容
1L某混合溶液,可能含有的离子如下表:
|
可能大量含有的阳离子 |
H+、Ag+、Mg2+、Al3+、NH4+、Fe3+ |
|
可能大量含有的阴离子 |
Cl-、Br-、I-、CO32-、Al(OH)4-(或AlO2-) |
Ⅰ、往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如下图所示.请回答下列问题:
(1)该溶液中一定不存在的阳离子是 。
(2)该溶液中一定不存在的阴离子是 。
(3)m→n反应的的离子方程式为 。
(4)溶液中含有的阳离子对应的物质的量比为 。
Ⅱ、经检测,该溶液中还含有大量的Cl-、Br-、I-,向混合溶液中加入足量的氯化铁溶液,请写出有关反应的离子方程式 。
Ⅰ、(1)Ag+、Mg2+、Fe3+,
(2)CO32- 、 Al(OH)4-(或AlO2-)
(3)NH4++OH-=NH3. H2O
(4)n(H+): n(NH4+):n(Al3+)=2:3:1
Ⅱ、2Fe3++2I-= I2+2Fe2+
【解析】
试题分析:Ⅰ、(1)分析题目所给图像,随着NaOH溶液的量逐渐增加,生成沉淀然后又逐渐完全溶解,说明原溶液含有Al3+,最后沉淀完全溶解,说明该溶液不含Ag+、Mg2+、Fe3+。
(2)Al3+能与CO32- 、 Al(OH)4-反应,所以这两种离子一定不存在。
(3)m→n段沉淀不变化,为NaOH与NH4+反应,离子方程式为:NH4++OH-=NH3. H2O。
(4)根据图中曲线可知:与H+反应消耗的NaOH溶液体积为2V0,则n(H+)=2 V0c(NaOH);与Al3+反应生成Al(OH)3,消耗了NaOH溶液3V0,则n(Al3+)= V0c(NaOH);与NH4+反应消耗的NaOH溶液的体积为3V0,则n(NH4+)=3 V0c(NaOH),所以n(H+): n(NH4+):n(Al3+)=2 V0c(NaOH):3 V0c(NaOH):V0c(NaOH)=2:3:1。
Ⅱ、Fe3+的氧化性大于I2,所以Fe3+可以把I‾氧化为I2,离子方程式为:2Fe3++2I-= I2+2Fe2+。
考点:本题考查图像的分析、溶液中离子的判断、离子方程式的判断及相关计算。

 1L某混合溶液.可能含有的离子如下表: 1L某混合溶液.可能含有的离子如下表:
|
(13分)1L某混合溶液,可能含有的离子如下表:
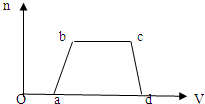
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
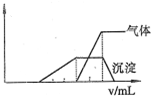
(1)往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)与加入NaOH溶液的体积(V)的关系如图所示。则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1、V2、 V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
(10分) 1L某混合溶液,可能含有的离子如下表:
| 可能大量含有的阳离子 | H+、K+、Mg2+、Al3+、NH、Fe2+、Fe3+ |
| 可能大量含有的阴离子 | Cl-、Br-、I-、CO32-、AlO |
⑴ 往该溶液中逐滴加入NaOH溶液,产生沉淀的物质的量(n)
与加入NaOH溶液的体积(V)的关系如右图所示。
则该溶液中一定不含有的离子是_________。
(2)BC段离子方程式为 。
(3)V1 、V2、V3、 V4之间的关系 。
(4)经检测,该溶液中还含有大量的Cl-、Br-、I-,若向1L该混合溶液中通入一定量的
Cl2,溶液中Cl-、Br-、I-的物质的量与通入Cl2的体积(标准状况)的关系如下表所示,
分析后回答下列问题:
| Cl2的体积(标准状况) | 2.8L | 5.6L | 11.2L |
| n(Cl-) | 1.25mol | 1.5mol | 2mol |
| n(Br-) | 1.5mol | 1.4mol | 0.9mol |
| n(I-) | a mol | 0 | 0 |
①当通入Cl2的体积为2.8L时,溶液中发生反应的离子方程式为___________________。
②原溶液中Cl-、Br-、I-的物质的量浓度之比为____________________。
 、Fe2+、Fe3+
、Fe2+、Fe3+