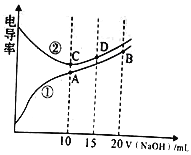
��Ŀ����
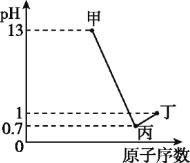
����Ŀ��X��Y��Z��WΪ���ֶ�����Ԫ��,���ǵ�����������Ӧˮ����ֱ�Ϊ�ס��ҡ��������������¼ס��������������ҷ�Ӧ�����κ�ˮ,Z��W��ԭ��������0.1 mol/L�ס���������Һ��pH��ͼ��ʾ(��֪lg2=0.3)������˵����ȷ����
A. �������ӵĻ�ԭ��:Z<W
B. X��Y�ֱ���W�γɵĻ������Ϊ���ӻ�����
C. �ҹ����м������Һ��Ũ��ˮ,���嶼���ܽ�
D. Y��Z�ļ����Ӷ���Ӱ��ˮ�ĵ���ƽ��
���𰸡�D
��������
X��Y��Z��WΪ���ֶ�����Ԫ�أ����ǵ�����������Ӧˮ����ֱ�Ϊ�ס��ҡ�����������ͼ�ɵã�0.1mol/L����Һ��pH=13�����ΪһԪǿ�ֻ��ΪNaOH����XΪNaԪ�أ�0.1mol/L�Ķ���ҺpH=1����ΪһԪ�����ᣬ����ΪW��ԭ����������NaԪ�أ���WΪClԪ�ء���ΪHClO4��0.1mol/L�ı���ҺpH=0.7����������Ũ��Ϊ10-0.7mol/L��0.2mol/L�����Ա�Ϊ��Ԫǿ�ᣬ����ΪZ��ԭ����������NaԪ�أ�����ZΪSԪ�ء���ΪH2SO4����Ϊ�����¼ס��������������ҷ�Ӧ�����κ�ˮ������Ϊ�����������������ӦΪAl(OH)3��YΪAlԪ�أ��ݴ˽��н��
�����������ɵã�X��Y��Z��W�ֱ�Ϊ��Na��Al��S��ClԪ�أ��ס��ҡ��������ֱ�Ϊ��NaOH��Al(OH)3��H2SO4��HClO4��
A�ZΪSԪ�ء�WΪClԪ�أ��ǽ�����Cl��S����Ϊ�ǽ�����Խǿ����Ӧ�������ӵĻ�ԭ��Խ������������ӵĻ�ԭ�ԣ�Z(S2-)��W(Cl-)����A����B�X��Y��W�ֱ�ΪNa��Al��ClԪ�أ�Na��ClԪ���γɵĻ�����NaClΪ���ӻ����Al��ClԪ���γɵĻ�����AlCl3Ϊ���ۻ������B����C���ΪAl(OH)3���������������ƣ��������ڰ�ˮ����C����D�Y��Z�ļ����ӷֱ�ΪAl3+��S2-�����߶��ܷ���ˮ��ٽ�ˮ�ĵ��룬��D��ȷ���������������������ѡ��ΪD��

����Ŀ�������̿����Ҫ�ɷ�MnO2������SiO2 ��Fe2O3��Al2O3��Cu2(OH)2CO3�ĵ����ʣ�����ϴ������Һ����1mol/LH2SO4��FeSO4��Һ���������������̺����죨Fe2O3��������������

Mn(OH)2 | Fe(OH)2 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | |
��ʼ����ʱ | 8.3 | 6.3 | 4.7 | 3.4 | 2.7 |
��ȫ����ʱ | 9.8 | 8.3 | 6.7 | 4.4 | 3.2 |
��1�������ʵ����̿�ʹ��ǰ�轫����飬Ŀ����______��
��2������1�к��е���Ҫ������_______��
��3����Һ1�У��Ӱ�ˮ������ҺpH��3.2��ͨ��O2����Ӧ�����ӷ���ʽ��_______������H2O2����O2���Ƿ������������___________��
��4�����̿�������������������Һ��Ӧ�����ӷ���ʽ��_________��
��5����Һ3�м������ܵ����MnS��Ŀ���ǣ������ӷ���ʽ��ʾ��_________��
��6�����ؽᾧ������Һ4�л�ȡ�����̾���IJ����ǣ�__________��
����Ŀ����������(ClNO)����NO��Cl2��ͨ�������·�Ӧ�õ�����ѧ����ʽΪ:2NO(g)+Cl2(g)![]() 2ClNO(g)��
2ClNO(g)��
(1)��һ���¶��£��÷�Ӧ��һ�����ܱ������дﵽƽ�����ͨ��Cl2���淴Ӧ����____(�������١�����)��
(2)��֪���ֻ�ѧ���ļ����������±�(NO�ĽṹΪ:N��O���������ȵĽṹΪCl-N=O)
��ѧ�� | N��O | Cl-Cl | Cl-N | N=O |
����(kJ/mol) | 630 | 243 | a | 607 |
2NO(g)+Cl2(g)![]() 2ClNO(g) ��H=-111kJ/mol��a=______��
2ClNO(g) ��H=-111kJ/mol��a=______��
(3)��1L�ĺ����ܱ������г���2molNO(g)��1molCl2(g)���ڲ�ͬ�¶��²��c(ClNO)��ʱ��Ĺ�ϵ��ͼA:
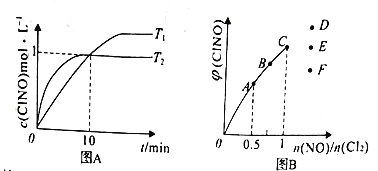
�ٸ÷�Ӧ��T1______T2(�>��<����=��)��
�ڷ�Ӧ��ʼ��10minʱNO��ƽ����Ӧ����v(NO)=_______mol/(L.min)��
��T2ʱ�÷�Ӧ��ƽ�ⳣ��K=________��
(4)һ���������ں��º��ݵ��ܱ������а�һ����������NO(g)��Cl2(g)��ƽ��ʱClNO�����������n(NO)/n(Cl2)�ı仯ͼ����ͼB,��A��B��C��״̬�У�NO��ת����������_____�㣬��n(NO)/n(Cl2)=1.5ʱ���ﵽƽ��״̬ClNO���������������D��E��F�����е�____�㡣