��Ŀ����
����Ŀ��50ml0.50molL��1������50mL0.55molL��1NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���� �зų��������ɼ����к��ȣ��ش��������⣺ 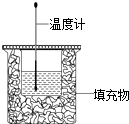
��1����ʵ��װ���Ͽ���ͼ��ȱ�ٵ������� ��
��2��ʵ��������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ����ų������������ȡ�����ȡ����������к��������ȡ�����ȡ�����
��3����50ml0.25molL��1H2SO4�������ᣬ��50mL0.275molL��1Ba��OH��2���� NaOH��Һ��������ʵ�飬��õ��к��ȵľ���ֵ�����ƫ��ƫС������Ӱ�족����
���𰸡�
��1������������
��2������ȣ����
��3��ƫ��
���������⣺��1���������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�������������Դ��ǣ����β������������2����Ӧ�ų����������������Լ�������Ķ����йأ�������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ������������أ�������70mL0.50molL��1�����70mL0.55molL��1NaOH��Һ���з�Ӧ����������ʵ�飬����к�����ֵ��ȣ����Դ��ǣ�����ȣ���ȣ���3��������Ba��OH��2��Һ��Ӧ��������ˮ�⣬��������BaSO4�������÷�Ӧ�е������Ȼ�Ӱ�췴Ӧ�ķ�Ӧ�ȣ����Բ�����Ba��OH��2��Һ���������NaOH��Һ��������к��ȣ�������к��ȵ���ֵƫ�����Դ��ǣ�ƫ��