题目内容
【题目】(题文)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。
已知:①AlCl3、FeCl3分别在183 ℃、315 ℃时升华;②无水AlCl3遇潮湿空气变质。
Ⅰ. 实验室可用下列装置制备无水AlCl3。
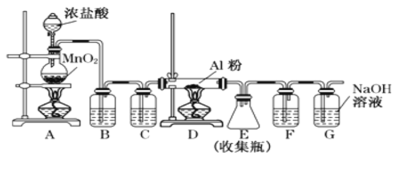
(1)组装好仪器后,首先应_____________,具体操作为_____________________
(2)装置 B中盛放饱和NaCl溶液,该装置的主要作用是__________________。装置C中盛放的试剂是________________。装置F中试剂的作用是__________。若用一件仪器装填适当试剂后也可起到F和G的作用,所装填的试剂为_______
(3)将所制得的无水AlCl3配制溶液时需加入盐酸的目的是_________
Ⅱ. 工业上可由铝土矿(主要成分是Al2O3和Fe2O3)和焦炭制备,流程如下:
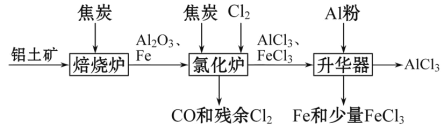
(1)氯化炉中Al2O3、Cl2和焦炭在高温下发生反应的化学方程式为___________________
(2)700 ℃时,升华器中物质充分反应后降温实现FeCl3和AlCl3的分离。温度范围应为_______
a.低于183 ℃ b.介于183 ℃和315 ℃之间 c.高于315 ℃
(3)样品(含少量FeCl3)中AlCl3含量可通过下列操作测得(部分物质略去)。
![]()
计算该样品中AlCl3的质量分数________(结果用m、n表示,不必化简)。
【答案】检查装置气密性关闭装置A中分液漏斗的活塞,向G中加入蒸馏水没过导管,微热A,一段时间后若G中有气泡冒出,停止加热后导管内有水柱,则气密性良好;除HCl浓硫酸吸收水,防止无水AlCl3遇潮湿空气变质碱石灰抑制铝离子水解Al2O3+3Cl2+3C![]() 2AlCl3+3COb
2AlCl3+3COb![]() ×100%或
×100%或![]() ×100%
×100%
【解析】
I.(1)此实验中有气体的参与,因此实验之前首先检验装置的气密性;检验气密性的方法,一般采用加热法和液差法两种;(2)利用题中信息,可以完成;(3)从水解的应用角度进行分析;II.(1)根据流程的目的,焦炭在高温下转化成CO,然后根据化合价升降法进行配平;(2)利用AlCl3和FeCl3升华的温度,进行分析;(3)根据元素守恒进行计算。
I.(1)装置A制备氯气,因此需要检验装置的气密性,本实验的气密性的检验方法是:关闭装置A中分液漏斗的活塞,向G中加入蒸馏水没过导管,微热A,一段时间后若G中有气泡冒出,停止加热后导管内有水柱,则气密性良好;(2)A中制备的氯气中混有HCl和H2O,HCl能与Al发生反应,AlCl3遇水易变质,因此必须除去HCl和H2O,装置B的作用是除去氯气中的HCl,装置C的作用是除去水蒸气,即盛放的是浓硫酸。因为AlCl3遇水易变质,因此装置F的作用是防止G中水蒸气进去E装置,使AlCl3变质;氯气有毒,需要吸收尾气,因此装置G的作用是吸收多余的氯气,防止污染空气,如果G和F改为一个装置,应用干燥管,盛放试剂为碱石灰;(3)AlCl3属于强酸弱碱盐,Al3+发生水解:Al3++3H2O![]() Al(OH)3+3H+,加入盐酸的目的是抑制Al3+的水解;II.(1)流程的目的是制备AlCl3,因此氯化炉中得到产物是AlCl3,焦炭在高温下,生成CO,因此反应方程式为Al2O3+3Cl2+3C
Al(OH)3+3H+,加入盐酸的目的是抑制Al3+的水解;II.(1)流程的目的是制备AlCl3,因此氯化炉中得到产物是AlCl3,焦炭在高温下,生成CO,因此反应方程式为Al2O3+3Cl2+3C![]() 2AlCl3+3CO;(2)AlCl3、FeCl3分别在183 ℃、315 ℃时升华,因此进行分离,需要控制温度在183℃到315℃之间,故选项b正确;(3)根据铝元素守恒,AlCl3的物质的量为n×2/102mol,则AlCl3的质量为133.5×2×n/102g,即AlCl3的质量分数为
2AlCl3+3CO;(2)AlCl3、FeCl3分别在183 ℃、315 ℃时升华,因此进行分离,需要控制温度在183℃到315℃之间,故选项b正确;(3)根据铝元素守恒,AlCl3的物质的量为n×2/102mol,则AlCl3的质量为133.5×2×n/102g,即AlCl3的质量分数为![]() ×100%或
×100%或![]() ×100%。
×100%。



