题目内容
将标况下2.24LCO2通入150mL 1mol?L-1的NaOH溶液中,下列说法正确的是( )
分析:n(CO2)=0.1mol,n(NaOH)=0.15mol,二者反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3,生成等物质的量的NaHCO3和Na2CO3,NaHCO3溶液和Na2CO3水解都呈碱性,且CO32-水解程度大于HCO3-,结合溶液的电中性原则、物料守恒以及质子守恒解答该题.
解答:解:n(CO2)=0.1mol,n(NaOH)=0.15mol,反应溶液中存在CO32-、HCO3-、H2CO3,根据物料守恒可知应存在2c(Na+)=3c(HCO3-)+3c(CO32-)+3c(H2CO3),故A错误;
二者反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3,生成等物质的量的NaHCO3和Na2CO3,NaHCO3溶液和Na2CO3水解都呈碱性,且CO32-水解程度大于HCO3-,则应有c(HCO3-)>c(CO32-),故B正确,由此可知C、D错误.
故选B.
二者反应的化学方程式为:2CO2+3NaOH=NaHCO3+Na2CO3,生成等物质的量的NaHCO3和Na2CO3,NaHCO3溶液和Na2CO3水解都呈碱性,且CO32-水解程度大于HCO3-,则应有c(HCO3-)>c(CO32-),故B正确,由此可知C、D错误.
故选B.
点评:本题考查离子浓度大小比较,题目难度中等,本题注意根据反应物的物质的量判断反应物,比较离子浓度大小关系时,常常用到电荷守恒、物料守恒以及质子守恒等方法,做题时注意体会.

练习册系列答案
 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案
相关题目
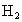 混合气体,在催化剂作用下充分反应,再将反应后的气体全部通入足量的溴水中,可生成3.76克1,2-二溴乙烷,求原混合气体中乙烯和
混合气体,在催化剂作用下充分反应,再将反应后的气体全部通入足量的溴水中,可生成3.76克1,2-二溴乙烷,求原混合气体中乙烯和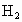 混合气体,在催化剂作用下充分反应,再将反应后的气体全部通入足量的溴水中,可生成3.76克1,2-二溴乙烷,求原混合气体中乙烯和
混合气体,在催化剂作用下充分反应,再将反应后的气体全部通入足量的溴水中,可生成3.76克1,2-二溴乙烷,求原混合气体中乙烯和