题目内容
14.某气体在标准状况下体积是4.48L,质量是14.2g,该气体的摩尔质量是( )| A. | 71 | B. | 71 g•mol-1 | C. | 28.4 | D. | 28.4 g•mol-1 |
分析 根据n=$\frac{m}{n}$=$\frac{V}{V{\;}_{m}}$计算.
解答 解:根据n=$\frac{m}{n}$=$\frac{V}{V{\;}_{m}}$,可知M=$\frac{m•V{\;}_{m}}{V}$=$\frac{14.2g×22.4L/mol}{4.48L}$=71g/mol.
故选B.
点评 本题考查了摩尔质量的概念和计算方法,注意摩尔质量是由单位的,单位为g/mol,题目难度不大,学习中注意相关基础知识的积累.

练习册系列答案
相关题目
4.下列溶液与30mL 1mol•L-1 NaNO3溶液中NO3-物质的量浓度相等的是( )
| A. | 10 mL 1 mol•L-1 NaNO3 溶液 | B. | 10 mL 1 mol•L-1Al(NO3)3 溶液 | ||
| C. | 15 mL 2 mol•L-1 AgNO3 溶液 | D. | 10 mL 1.5 mol•L-1Cu(NO3)2 溶液 |
2.如图为铜锌原电池示意图,下列说法错误的是( )
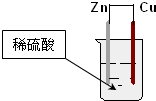

| A. | 铜片表面有气泡产生 | B. | 负极反应为:Cu-2e-=Cu2+ | ||
| C. | 锌为负极,铜为正极 | D. | 电子通过锌片经导线流向铜片 |
9.下列有关氧化还原反应的叙述正确的是( )
| A. | 化合反应和复分解反应不可能是氧化还原反应 | |
| B. | 阳离子只能得到电子被还原,阴离子只能失去电子被氧化 | |
| C. | 含有最高价元素的化合物不一定具有很强的氧化性 | |
| D. | 在氧化还原反应中肯定有一种元素被氧化,另一种元素被还原 |
19.已知某化学反应的平衡常数表达式为K=$\frac{c(C{O}_{2})•c({H}_{2})}{c(CO)•c({H}_{2}O)}$,在不同的温度下该反应的平衡常数如右表:下列有关叙述正确的是( )
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 1.67 | 1.11 | 1.00 | 0.60 | 0.38 |
| A. | 若平衡浓度符合下列关系式:$\frac{c(C{O}_{2})}{3c(CO)}$=$\frac{c({H}_{2}O)}{5c({H}_{2})}$,则此时的温度为1000℃ | |
| B. | 上述反应的逆反应是放热反应 | |
| C. | 该反应的化学方程式是:CO2(g)+H2(g)?CO(g)+H2O(g) | |
| D. | 若在一定体积的密闭容器中通入CO2和H2各1mol,5min后温度升高到830℃,此时测得CO2为0.4mol时,该反应达到平衡状态 |
6.HPE是合成除草剂的重要中间体,其结构简式如图所示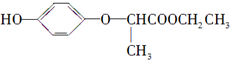 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )
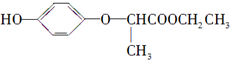 下列有关HPE的说法正确的是( )
下列有关HPE的说法正确的是( )| A. | 1 mol HPE最多可和2 mol NaOH反应 | |
| B. | HPE不能跟浓溴水反应 | |
| C. | HPE不能发生加成反应 | |
| D. | HPE在核磁共振氢谱中有6个峰 |
4.氯化铵是一种重要化工原料,也是一种常用的氨肥.
(1)氯化铵作为化肥时不宜与草木灰(主要成分K2CO3)混用.其原因是氯化铵与碳酸钾发生相互促进的水解反应生成氨气,会降低肥效.
(2)热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:6NH4++Fe2O3$\frac{\underline{\;加热\;}}{\;}$2Fe3++6NH3↑+3H2O.
(3)常温下,在20mLamol.L-1氨水中滴加加20mLbmol.L-1HCl溶液恰好至溶液呈中性.计算常温下,NH3.H2O的电离常数Kb=$\frac{a}{a-b}$×10-7mol/L(用含a,b的精确代数式表示)
(4)为了探究外界条件对氯化铵水解平衡的影响,设计如下实验方案:
限选药品和仪器:恒温水浴、pH计、烧杯、0.1mol.L-1硝酸银溶液、蒸馏水和各种浓度的NH4Cl溶液.
①实验中,“待测物理量”是溶液的pH.
②i=30;ii:探究温度对氯化铵水解平衡的影响.
③上述表格中,y>(填“>”“<”或“=”)m.
(1)氯化铵作为化肥时不宜与草木灰(主要成分K2CO3)混用.其原因是氯化铵与碳酸钾发生相互促进的水解反应生成氨气,会降低肥效.
(2)热的浓氯化铵溶液可以清洗铁器表面锈迹,写出相关反应的离子方程式:6NH4++Fe2O3$\frac{\underline{\;加热\;}}{\;}$2Fe3++6NH3↑+3H2O.
(3)常温下,在20mLamol.L-1氨水中滴加加20mLbmol.L-1HCl溶液恰好至溶液呈中性.计算常温下,NH3.H2O的电离常数Kb=$\frac{a}{a-b}$×10-7mol/L(用含a,b的精确代数式表示)
(4)为了探究外界条件对氯化铵水解平衡的影响,设计如下实验方案:
| 实验序号 | c(NH4Cl)/mol.L-1 | 温度/℃ | 待测物理量 | 实验目的 |
| Ⅰ | 0.5 | 30 | x | - |
| Ⅱ | 1.5 | i | y | 探究浓度对氯化铵水解平衡的影响 |
| Ⅲ | 0.5 | 35 | z | ii |
| Ⅳ | 2.0 | 40 | m | 探究温度、浓度同时对氯化铵水解平衡的影响 |
①实验中,“待测物理量”是溶液的pH.
②i=30;ii:探究温度对氯化铵水解平衡的影响.
③上述表格中,y>(填“>”“<”或“=”)m.
