题目内容
19.鉴别甲苯、苯乙烯、苯酚、丙烯酸溶液可选用( )| A. | KMnO4溶液、FeCl3溶液 | B. | KMnO4溶液、溴水 | ||
| C. | 溴水、Na2CO3溶液 | D. | FeCl3溶液、NaOH溶液 |
分析 苯乙烯含有C=C官能团,可发生加成反应,能使酸性高锰酸钾溶液褪色,苯酚含有酚羟基,可与溴水发生取代反应,具有还原性,甲苯可与酸性高锰酸钾发生氧化还原反应,丙烯酸具有羧酸和烯烃类物质的化学性质,以此解答该题.
解答 解:A.甲苯、苯乙烯、苯酚、丙烯酸都可被酸性高锰酸钾氧化,不能鉴别,FeCl3溶液只能鉴别苯酚,故A错误;
B.甲苯、苯乙烯、苯酚、丙烯酸都可被酸性高锰酸钾氧化,溴水不能鉴别苯乙烯和丙烯酸,故B错误;
C.苯乙烯和丙烯酸均能和溴水发生加成反应而使之褪色,丙烯酸溶液可以和碳酸钠发生反应生成二氧化碳气体,甲苯和溴水混合会分层,苯酚会和溴水反应生成白色沉淀,现象不一样,可以鉴别,故C正确;
D.FeCl3溶液只能鉴别苯酚,氢氧化钠不能鉴别甲苯、苯乙烯,二者都不溶于水,且密度比水小,氢氧化钠也不能鉴别苯酚、丙烯酸,故D错误.
故选C.
点评 本题考查有机物的鉴别,明确常见有机物的性质是解答的关键,注意利用性质的差异及不同现象来鉴别,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.下列离子方程式中正确的是( )
| A. | 碳酸氢铵溶液中加入过量氢氧化钠溶液:HCO3-+OH-=CO32-+H2O | |
| B. | 氯化铝溶液中加入过量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| C. | 二氧化氮通入水中:3NO2+H2O=2H++2NO3-+NO | |
| D. | 氯气通入水中的反应:Cl2+H2O=2H++Cl-+ClO- |
10.设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 足量Fe在1 mol Cl2中充分燃烧,转移2NA个电子 | |
| B. | 在标准状况下,22.4L甲烷与18g水所含有的电子数均为10NA | |
| C. | 含NA个Na+的Na2O溶解于1L水中,Na+浓度为1mol•L-1 | |
| D. | 同一温度下1L0.5mol/LNH4Cl溶液与2L0.25mol/LNH4Cl溶液所含NH4+的物质的量相同 |
14.根据元素周期表中元素性质变化规律,ⅥA族元素不可能有的性质是( )
| A. | 从上到下非金属性减弱 | B. | 从上到下元素原子半径增大 | ||
| C. | 从上到下单质熔沸点升高 | D. | 该族元素都有的化合价为+6、-2 |
9.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 相同质量的N2和CO所含有的分子数、原子总数、电子总数都相等 | |
| B. | 50ml18.4 mol/L浓硫酸与足量铜加热反应,生成S02分子的数目为0.4 6 NA | |
| C. | 0.1mol/LMgCl2溶液中含有的Mg2+数目一定小于0.1NA | |
| D. | 1 mol CH5+中含有的电子数目为11NA |
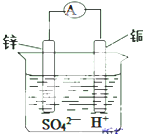 如图为某原电池示意图,请回答:
如图为某原电池示意图,请回答: .(2)HClO:
.(2)HClO: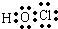 .
.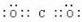 .(4)MgCl2:
.(4)MgCl2: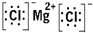 .
. . (6)H2S:
. (6)H2S: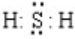 .
.