题目内容
18.下列关于苯的叙述正确的是( )
| A. | 反应①为取代反应,有机产物与水混合浮在上层 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有浓烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应为加成反应,生成物为芳香烃 |
分析 A.苯和液溴发生取代反应生成溴苯,溴苯密度大于水;
B.苯燃烧生成二氧化碳或CO和水,苯中含碳量较高;
C.苯和浓硝酸发生取代反应生成硝基苯,硝基苯中含有C、H、O、N元素;
D.苯与氢气加成生成环己烷.
解答 解:A.苯和液溴发生取代反应生成溴苯,溴苯密度大于水,所以溴苯位于水的下层,故A错误;
B.苯燃烧生成二氧化碳或CO和水,苯中含碳量较高,所以苯燃烧属于氧化反应,反应现象是火焰明亮并带有浓烟,故B正确;
C.苯和浓硝酸发生取代反应生成硝基苯,硝基苯中含有C、H、O、N元素,硝基苯属于烃的衍生物,故C错误;
D.苯与氢气加成生成环己烷,环己烷不属于芳香烃,故D错误;
故选:B.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生分析判断能力,明确苯的结构和性质、基本概念是解本题关键,注意苯中存在的化学键,为易错点.

练习册系列答案
 培优三好生系列答案
培优三好生系列答案
相关题目
7.只含有C、H、O三种元素,且完全燃烧时消耗O2和生成CO2的体积比为1:2(相同状况)的一类有机物中,下列说法正确的是( )
| A. | 相对分子质量最小的化合物是CH2O | |
| B. | 相对分子质量最小的化合物是C2H4O4 | |
| C. | 含相同碳原子数的各化合物,其相对分子质量之差是18的整数倍 | |
| D. | 含相同碳原子数的各化合物均具有相同的碳元素的质量分数 |
9.下列说法正确的是( )
| A. | 原电池是把电能转化成化学能的装置 | |
| B. | 原电池内部的阴离子向正极移动 | |
| C. | 原电池的两极分别发生氧化反应和还原反应 | |
| D. | 原电池中电子流出的一极是正极,发生氧化反应 |
6.下列关于碱金属的原子结构和性质的叙述不正确的是( )
| A. | 碱金属元素的原子在化学反应中容易失去电子 | |
| B. | 碱金属单质都是强还原剂 | |
| C. | 碱金属单质都能在O2中燃烧生成过氧化物 | |
| D. | 碱金属单质都能与水反应生成碱 |
13. 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
 氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如图.下列有关氢氧燃料电池的说法正确的是( )| A. | 该电池工作时电能转化为化学能 | |
| B. | 有1mol电子转移时,反应的氧气为5.6L | |
| C. | 外电路中电流由电极b通过导线流向电极a | |
| D. | 电极b的反应为:O2+4e-+H2O=4OH- |
10. 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
 常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )
常温下,向100mL 0.01mol•L-1 HA溶液中逐滴加入0.02mol•L-1 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(稀溶液混合时体积可直接相加).下列判断错误的是( )| A. | 由图中信息可知,HA一定是强酸 | |
| B. | 当V(MOH)=50.00 mL时,混合溶液中c(M+)+c(MOH)=0.01 mol•L-1 | |
| C. | N点对应的溶液中c(M+)=c(A-) | |
| D. | K点所对应的溶液中离子浓度大小关系为:c(M+)>c(A-)>c(OH-)>c(H+) |
1.以下表示氦原子结构的化学用语中,对电子运动状态描述最详尽的是( )
| A. | He | B. |  | C. | 1s2 | D. | 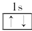 |
5. 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
(4)若保持温度不变,再向该容器内充入与起始量相等的CO2和H2,重新达到平衡时,CH4的浓度D (填字母).
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
 二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.
二氧化碳被认为是加剧温室效应的主要物质,资源化利用二氧化碳不仅可减少温室气体的排放,还可重新获得燃料或重要工业产品.Ⅰ.有科学家提出可利用FeO吸收和利用CO2,相关的热化学方程式如下:
6FeO(s)+CO2(g)═2Fe3O4(s)+C(s),△H=-76.0kJ•mol-1
②3FeO(s)+H2O(g)═Fe3O4(s)+H2(g)△H=-18.7kJ•mol-1
(1)在上述反应中①中,每吸收1molCO2,就有4 molFeO被氧化.
(2)试写出C(s)与水蒸气反应生成CO2和H2的热化学方程式C(s)+2H2O(g)=CO2(g)+2H2(g)△H=+38.6kJ/mol
Ⅱ.一定条件下,二氧化碳转化为甲烷.向一容积为2L的恒容密闭容器中充人一定量的CO2和H2,在300℃时发生上述反应的反应CO2(g)+4H2(g)?CH4(g)+2H2O(g).达到平衡时,各物质的浓度分别为CO20.2mol•L-1、CH40.8mol•L-1、H20.8mol•L-1,H2O1.6mol•L-1
(3)在300℃是,将各物质按下列起始浓度(mol•L-1)加入该反应容器中,达到平衡后,各组分浓度与上述题中描述的平衡浓度相同的是A、D.
| 选项 | CO | H2 | CH4 | H2O |
| A | 0 | 0 | 1 | 2 |
| B | 2 | 8 | 0 | 0 |
| C | 1 | 4 | 1 | .2 |
| D | 0.5 | 2 | 0.5 | 1 |
A.c(CH4)=0.8mol•L-1 B.0.8mol•L-1>c(CH4)>1.6mol•L-1
C.c(CH4)=l.6mol•L-1 D.C(CH4)>1.6mol•L-1
(5)在300℃时,如果向该容器中加入CO20.8mol•L-1、H21.0mol•L-1、CH4 2.8mol•L-1、H2O 2.0mol•L-1,则该可逆反应初始时叫v正> v逆 (填“>”或“<”).
(6)若已知200℃时该反应的平衡常数K=64.8 则该反应的△H< 0(填“>”或“<”).
Ⅲ.某高校的研究人员研究出一种方法,可实现水泥生产时CO2零排放,其基本原理如图所示
(7)上述电解反应在温度小于900℃时进行,碳酸钙先分解为CaO和CO2,电解质为熔融合碳酸钙,阴极的电极反应式为3CO2+4e-═C+2CO32-,则阳极的电极反应式为2CO32--4e-=2CO2↑+O2↑.
 已知:向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池.
已知:向FeCl2溶液中滴加稀硝酸,溶液颜色由浅绿色变为棕黄色.某同学用此反应设计了如图所示原电池.