题目内容
在密闭容器中进行如下反应:I2(g)+H2(g)  2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
 2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )
2HI(g),已知I2、H2、HI的起始浓度分别为0.1mol/L、0.3mol/L、0.2mol/L,在一定条件下当反应达到平衡时,各物质的浓度有可能是( )| A.HI为0.4mol/L | B.H2为0.15mol/L | C.I2为0.2mol/L | D.HI为0.35mol/L |
D
试题分析:可逆反应的特点的反应物与生成物共存。即物质不能完全转化。A.若HI为0.4mol/L,则I2(g)的浓度为0,这是不可能的,错误;B.若H2为0.15mol/L,H2消耗0.15mol/L,因为I2(g)和H2(g)是按照1:1关系反应的,开始时只有0.1mol/L的I2(g),这是不可能的,错误;C.若I2为0.2mol/L浓度增加了0.1mol/L, HI的消耗的浓度为0.2mol/L,这时HI的浓度为0,这是违背可逆反应的规律的,错误;D.若HI为0.35mol/L,增加了0.15mol/L,根据方程式中各种物质的浓度变化关系可知消耗I2、H2的浓度分别为0.075mol/L,它们还有剩余,符合可逆反应的特点,正确。

练习册系列答案
相关题目
 3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是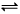 2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是
2C(g) ,下列关于该反应达到平衡状态的标志的说法中不正确的是 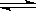 2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是
2Z2在反应过程中的反应速率V与时间(t)的关系曲线,下列叙述正确的是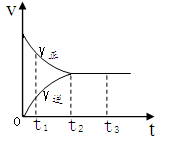
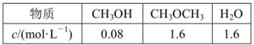
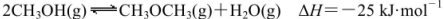 。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是
。某温度下的平衡常数为400。此温度下,在1L体积不变的密闭容器中加入CH3OH,某时刻测得各组分的物质的量浓度如表,下列说法中不正确的是