题目内容
14.如图是氢氧燃料电池(电解质溶液为H3PO4溶液)构造示意图.关于该电池的说法不正确的是( )
| A. | a极是负极 | |
| B. | 电子由a通过灯泡流向b | |
| C. | 正极的电极反应是:O2+2H2O+4e-=4OH- | |
| D. | 氢氧燃料电池是环保电池 |
分析 氢氧燃料电池中,通入氢气的一极为电源的负极,发生氧化反应,电极反应式为H2-2e-=2H+,通入氧气的一极为原电池的正极,电极反应式为O2+4H++4e-=2H2O,原电池工作时,电子由负极经外电路流向正极.
解答 解:A、氢氧燃料电池中,H2在负极a上被氧化,O2在正极b上被还原,故A正确;
B、原电池工作时,电子由负极经外电路流向正极,即由a通过灯泡流向b,故B正确;
C、通入氧气的一极为原电池的正极,由于电解质溶液为酸性,故正极的电极反应是:O2+4H++4e-=2H2O,故C错误;
D、氢氧燃料电池的总反应为:2H2+O2=2H2O,属于环保电池,故D正确.
故选C.
点评 本题考查原电池的工作原理,题目难度不大,注意把握电极方程式的书写,特别是电解质溶液的酸碱性.

练习册系列答案
相关题目
7.以下物质;①甲烷;②苯;③聚乙烯;④苯乙烯;⑤2-丁炔;⑥环己烷;⑦邻二甲苯.既能使KMnO4酸性溶液褪色,又能使溴水因发生化学反应而褪色的是( )
| A. | ④⑤ | B. | ④⑤⑦ | C. | ③④⑤ | D. | ③④⑤⑦ |
2.下列离子方程式书写不正确的是( )
| A. | 少量铁粉加入稀盐酸中:Fe+2H+=Fe2++H2↑ | |
| B. | Ca(HCO3)2溶液与过量Ca(OH)2溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | |
| C. | NH4HCO3溶液和过量Ba(OH)2溶液共热:2HCO3-+2OH-+Ba2+=BaCO3↓+CO32-+2H2O | |
| D. | Na2S溶液中通入足量H2S:S2-+H2S=2HS- |
9.一定温度时,测得反应X(g)+Y(g)═P(g)+Q(g)的平衡常数K=1.0.该温度下向甲、乙、丙三个恒容密闭容器中分别通入气体X和气体Y,其起始浓度如下表所示:
下列说法不正确的是( )
| 起始浓度 | 甲 | 乙 | 丙 |
| c(X)/(mol/L) | 0.10 | 0.10 | 0.20 |
| c(Y)/(mol/L) | 0.15 | 0.18 | 0.30 |
| A. | 反应开始时,甲中反应速率最慢,丙中反应速率最快 | |
| B. | 反应达到平衡时,甲、丙中Q的体积分数相等 | |
| C. | 乙中反应达到平衡时,X的转化率大于60% | |
| D. | 甲中反应达到平衡时,c(Y)=0.10mol/L |
6.以NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 在标准状况下,11.2 L己烷含有分子数为0.5NA | |
| B. | 4.2 g乙烯和环丙烷的混合气体含有H原子数为0.6NA | |
| C. | 甲基(-CH3)的电子总数为10NA | |
| D. | 在常温常压下,2.24 L丁烷和2-甲基丙烷的混合气体所含分子数为0.1NA |
3.运用元素周期律分析下面的推断,其中不正确的是( )
| A. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| B. | 砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 | |
| C. | 在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 | |
| D. | 硒化氢(H2Se)是有色、有毒的气体,比H2S稳定 |
1.下列属于有机物的是( )
| A. | 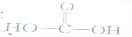 | B. | KSCN | C. | 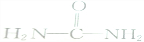 | D. | NH4HCO3 |
 .
.