题目内容
氯气是一种重要的化工原料。工业上常用反应3Cl2+8NH3===N2+6NH4Cl检验氯气管道是否漏气。根据材料中的反应回答下列问题:
(1)氧化剂是________,还原剂是________。
(2)氧化剂与被氧化的还原剂分子个数比为________。
(3)当有68 g NH3参加反应时,被氧化的物质为______g,生成的还原产物为________g。
解析: 在该反应中,参与反应的NH3一部分做还原剂被氧化为N2,一部分化合价不变,没有参与氧化还原反应,当有3 mol Cl2参与反应时,被氧化的NH3为2 mol,被氧化的NH3占参与反应的NH3的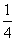 ,当有68 g NH3参与反应时,被氧化的物质为68 g×
,当有68 g NH3参与反应时,被氧化的物质为68 g×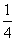 =17 g,生成的还原产物为NH4Cl,设其质量为x,则:
=17 g,生成的还原产物为NH4Cl,设其质量为x,则:
8NH3+3Cl2===6NH4Cl+N2
8×17 6×53.5
68 g x
x=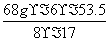 =160.5 g。
=160.5 g。
答案: (1)Cl2 NH3 (2)3∶2 (3)17 160.5

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
 Mg(NO3)2
Mg(NO3)2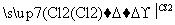 MgCl2
MgCl2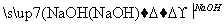 Mg(OH)2
Mg(OH)2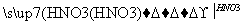 Mg(NO3)2
Mg(NO3)2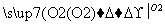 MgO
MgO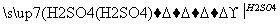 MgSO4
MgSO4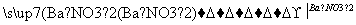 Mg(NO3)2
Mg(NO3)2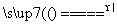 2KNO2+O2↑
2KNO2+O2↑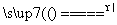 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑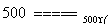 2H2O+2Cl2
2H2O+2Cl2