题目内容
下列关于电解质溶液的叙述正确的是
| A.常温下,Na2CO3溶液的pH>7 |
| B.0.1mol/L Na2CO3溶液在35℃时碱性比25℃强,说明该水解反应是是放热反应 |
| C.常温下.pH=7的NH4Cl与氨水的混合溶液中各离子浓度的关系为: c(Cl-)=c(NH4+)>c(H+)=c(OH一) |
| D.常温下,中和pH与体积均相同的盐酸和醋酸,消耗NaOH的物质的量相同 |
AC
试题分析:A、由于CO32-发生水解:CO32—+H2O
 HCO3—+OH—,溶液显碱性,正确;B、说明水解是吸热的,错误;C、NH4Cl完全电离为NH4+和Cl-,加少量的氨水抑制NH4+的水解,由电荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)变形可得:c(Cl-)=c(NH4+)>c(H+)=c(OH一),正确;D、醋酸是弱酸,部分电离,pH相同的盐酸与醋酸中是醋酸浓度远大于盐酸,体积相同时消耗NaOH是醋酸远大于盐酸,错误。
HCO3—+OH—,溶液显碱性,正确;B、说明水解是吸热的,错误;C、NH4Cl完全电离为NH4+和Cl-,加少量的氨水抑制NH4+的水解,由电荷守恒式: c(NH4+)+c(H+)=c(OH一) +c(Cl-)变形可得:c(Cl-)=c(NH4+)>c(H+)=c(OH一),正确;D、醋酸是弱酸,部分电离,pH相同的盐酸与醋酸中是醋酸浓度远大于盐酸,体积相同时消耗NaOH是醋酸远大于盐酸,错误。
练习册系列答案
 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案
相关题目

 、K+、
、K+、
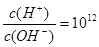 的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42-
的溶液中能大量共存的离子组:Na+、NO3-、I-、SO42- 、H+
、H+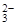 、Cl-
、Cl- 、OH-
、OH-