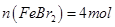题目内容
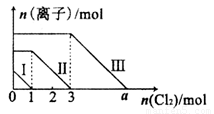
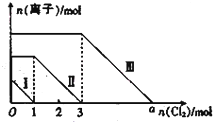 向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br-的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )分析:向仅含Fe2+、I-、Br-的溶液中通入适量氯气,根据还原性:I->Fe2+>Br-,首先发生反应:2I-+Cl2═I2+2Cl-,I-反应完毕,再发生反应:2Fe2++Cl2═2Fe3++2Cl-,Fe2+反应完毕,最后发生反应:2Br-+Cl2═Br2+2Cl-,故线段Ⅰ代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,
根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),
故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
根据溴离子判断溶液中n(FeBr2);
根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,
根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),
故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
根据溴离子判断溶液中n(FeBr2);
根据离子方程式计算溴离子反应需要的氯气的物质的量,据此计算a的值;
解答:解:向仅含Fe2+、I-、Br-的溶液中通入适量氯气,根据还原性:I->Fe2+>Br-,首先发生反应:2I-+Cl2=I2+2Cl-,I-反应完毕,再发生反应:2Fe2++Cl2=2Fe3++2Cl-,Fe2+反应完毕,最后发生反应:2Br-+Cl2=Br2+2Cl-,故线段Ⅰ代表I-的变化情况,线段Ⅱ代表Fe2+的变化情况,线段Ⅲ代表Br-的变化情况;
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,
根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),
故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
A、由上述分析可知,线段Ⅲ代表Br-的变化情况,故A错误;
B、由上述分析可知,线段I代表I-的变化情况,故B错误;
C、由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2═Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故C正确;
D、溶液中n(Br-)=6mol,所以原混合溶液中n(FeBr2)=3mol,故D错误;
故选:C.
由通入氯气可知,根据反应离子方程式可知溶液中n(I-)=2n(Cl2)=2mol,溶液中n(Fe2+)=2n(Cl2)=2×(3mol-1mol)=4mol,Fe2+反应完毕,
根据电荷守恒可知n(I-)+n(Br-)=2n(Fe2+),
故n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,
A、由上述分析可知,线段Ⅲ代表Br-的变化情况,故A错误;
B、由上述分析可知,线段I代表I-的变化情况,故B错误;
C、由上述分析可知,溶液中n(Br-)=2n(Fe2+)-n(I-)=2×4mol-2mol=6mol,根据2Br-+Cl2═Br2+2Cl-可知,溴离子反应需要的氯气的物质的量为3mol,故a=3+3=6,故C正确;
D、溶液中n(Br-)=6mol,所以原混合溶液中n(FeBr2)=3mol,故D错误;
故选:C.
点评:本题考查氧化还原反应计算、氧化还原反应先后顺序、氧化性和还原性强弱比较,综合性较强,难度较大,清楚反应过程是解题关键.

练习册系列答案
 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案
相关题目
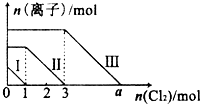 向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br-的溶液中通入适量氯气,溶液中这三种离子的物质的量随消耗氯气物质的量的变化如图所示.下列说法中正确的是( )