题目内容
【题目】自然界氮的循环过程如图.回答下列问题。
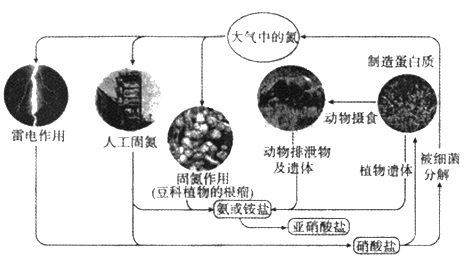
(1)上图中包含了_____种氮的固定方式,写出属于雷电作用固氮的化学方程式________。
(2)合成氮反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是______。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
(3)氮的循环中,亚硝酸盐是重要的一环,利用化合价可推知亚硝酸盐具有_____性和_____性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为__________________。
(4)某同学加热Fe(NO3)2时,发现得到了红色固体和红色气体,且所得气体被水充分吸收后体积少于原体积的l/3,Fe(NO3)2热分解的化学方程式为_______________。
【答案】 3 N2+O2![]() 2NO B 氧化 还原 5NO2-+2MnO4-+6H+=2Mn2++5NO3-+3H2O 4Fe(NO3)2
2NO B 氧化 还原 5NO2-+2MnO4-+6H+=2Mn2++5NO3-+3H2O 4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑
2Fe2O3+8NO2↑+O2↑
【解析】(1)图中包含了三种氮的固定方式,即人工固氮、自然固氮和根瘤菌固氮;放电条件下氮气转化为NO,NO与氧气化合生成NO2,NO2溶于水生成硝酸,因此雷电作用固氮的化学方程式为N2+O2![]() 2NO。(2)A.催化剂可以加快反应速率,A正确;B.催化剂不能改变反应热,B错误;C.催化剂能降低活化能,因此可以减少反应中的能耗,C正确;D. 催化剂能降低活化能,可以增加活化分子的数目,D正确,答案选B。(3)亚硝酸盐中氮元素是+3价,处于中间价态,因此可推知亚硝酸盐具有氧化性和还原性;高锰酸钾具有强氧化性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为5NO2-+2MnO4-+6H+=2Mn2++5NO3-+3H2O。(4)某同学加热Fe(NO3)2时,发现得到了红色固体和红色气体,分别是氧化铁和NO2,所得气体被水充分吸收后体积少于原体积的l/3,这说明反应中还有氧气生成,所以Fe(NO3)2热分解的化学方程式为4Fe(NO3)2
2NO。(2)A.催化剂可以加快反应速率,A正确;B.催化剂不能改变反应热,B错误;C.催化剂能降低活化能,因此可以减少反应中的能耗,C正确;D. 催化剂能降低活化能,可以增加活化分子的数目,D正确,答案选B。(3)亚硝酸盐中氮元素是+3价,处于中间价态,因此可推知亚硝酸盐具有氧化性和还原性;高锰酸钾具有强氧化性,亚硝酸盐和酸性高锰酸钾反应的离子方程式为5NO2-+2MnO4-+6H+=2Mn2++5NO3-+3H2O。(4)某同学加热Fe(NO3)2时,发现得到了红色固体和红色气体,分别是氧化铁和NO2,所得气体被水充分吸收后体积少于原体积的l/3,这说明反应中还有氧气生成,所以Fe(NO3)2热分解的化学方程式为4Fe(NO3)2![]() 2Fe2O3+8NO2↑+O2↑。
2Fe2O3+8NO2↑+O2↑。

