题目内容
【题目】2.3 g纯净的金属钠在干燥的空气中缓慢加热,被氧化后得到3.5 g固体,由此可判断出产物是( )
A.氧化钠B.过氧化钠
C.氧化钠和过氧化钠的混合物D.无法确定
【答案】C
【解析】
金属钠在空气中缓慢加热,得到的固体可能为氧化钠、过氧化钠、氧化钠与过氧化钠的混合物,钠元素在反应前后质量不变,固体增重量为氧元素,可根据差量法和极值法判断固体组分。
2.3g金属钠的物质的量为![]() =0.1mol,固体反应前后质量差为3.5g-2.3g=1.2g,故氧原子物质的量为
=0.1mol,固体反应前后质量差为3.5g-2.3g=1.2g,故氧原子物质的量为![]() =0.075mol,若固体全部为氧化钠,则氧原子物质的量为0.05mol,若固体全部为过氧化钠,则氧原子物质的量为0.1mol,因被氧化后的固体中氧原子物质的量为0.05mol<0.075mol<0.1mol,故该氧化物中固体为氧化钠和过氧化钠的混合物,
=0.075mol,若固体全部为氧化钠,则氧原子物质的量为0.05mol,若固体全部为过氧化钠,则氧原子物质的量为0.1mol,因被氧化后的固体中氧原子物质的量为0.05mol<0.075mol<0.1mol,故该氧化物中固体为氧化钠和过氧化钠的混合物,
故答案为C。

 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案【题目】Ⅰ、重金属离子对河流及海洋造成严重污染。某化工厂废水(pH=2.0,ρ≈1g·mL-1)中含有Ag+、Pb2+等重金属离子,其浓度各约为0.01mol·L-1。排放前拟用沉淀法除去这两种离子,查找有关数据如下:
难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
Ksp | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
(1)你认为往废水中投入_____(填字母序号),沉淀效果最好。
A.NaOH B.Na2S C.KI D.Ca(OH)2
(2)常温下,如果用生石灰处理上述废水,使溶液的pH=8.0,处理后的废水中c(Pb2+)=___。
(3)如果用食盐处理其只含Ag+的废水,测得处理后的废水中NaCl的质量分数为0.117%。若环境要求排放标准为c(Ag+)低于1.0×10-8mol·L-1,问该工厂处理后的废水中c(Ag+)=__,是否符合排放标准__(填“是”或“否”)。已知Ksp(AgCl)=1.8×10-10mol2·L-2。
Ⅱ、为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2mL0.005 mol/LAgNO3溶液中加入2 mL0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/LKI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)=8.3×1017 ,Ksp(AgSCN,白色)= 1.0×1012 。
回答下列问题:
(4)步骤3中现象a是_______。
(5)向50mL0.005 mol/L的AgNO3溶液中加入150mL0.005 mol/L的KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为____
【题目】下图所示的装置中,烧瓶中充满干燥气体a,然后打开弹簧夹f,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,烧瓶中的液体d呈喷泉喷出,最终几乎充满烧瓶。下列各组不可能出现上述现象的是
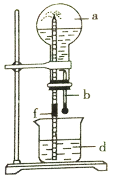
序号 | a(干燥气体) | b(液体)与d(液体) |
A | NO | 水 |
B | CO2 | 4mol·L-1NaOH溶液 |
C | Cl2 | 4mol·L-1NaOH溶液 |
D | NH3 | 1mol·L-1盐酸 |
A.AB.BC.CD.D
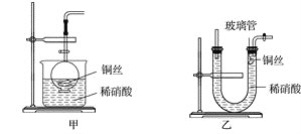
【题目】下述实验中均有红棕色气体产生,对比分析所得结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸发生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2,由此说明木炭一定与浓硝酸发生了反应